DE oxidatie en de vermindering zijn reacties die optreden als er een elektronenoverdracht tussen chemische soorten. Het zijn tegengestelde reacties: bij een oxidatie is er een verlies van elektronen en bij een reductie is er een winst van elektronen.
Deze processen vinden gelijktijdig plaats, want wanneer een stof elektronen afstaat aan een andere, wordt deze geoxideerd, terwijl de stof die elektronen ontvangt, wordt gereduceerd.
Wanneer een stof oxideert, zorgt dit ervoor dat de andere soort vermindert, vandaar de naam van een reductiemiddel. Evenzo vermindert de ene stof door de oxidatie van een andere en is daarom het oxidatiemiddel.
De oxidatie- en reductiereacties worden aangetoond door de variatie van het oxidatiegetal (nox) van de betrokken soorten.
Over het algemeen kan een reactie die oxidatie en reductie presenteert worden weergegeven door:
A + B+ → A+ + B
Waar,
A: stof die wordt geoxideerd, verliest elektronen, verhoogt zijn waarde en is het reductiemiddel.
B: stof die reductie ondergaat, elektronen opneemt, oxidatie vermindert en het oxidatiemiddel is.
Voorbeelden van oxidatie en reductie
Zie de volgende afbeelding voor een voorbeeld van de chemische redoxvergelijking.
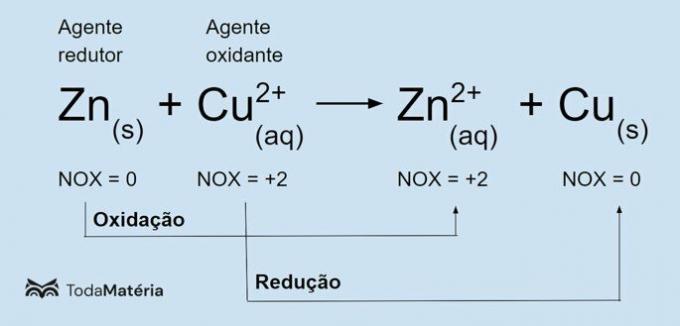
Het metallische zink ondergaat oxidatie en veroorzaakt de reductie van koper, dus het is het reductiemiddel. Het oxidatiegetal (nox) neemt toe van 0 tot +2 omdat het 2 elektronen verliest.
Het cupri-ion (Cu2+) ondergaat reductie en zorgt ervoor dat koper oxideert, dus het is het oxidatiemiddel. Het oxidatiegetal (nox) neemt af van +2 naar 0 omdat het 2 elektronen krijgt en metallisch koper wordt, dat elektrisch neutraal is.
Andere voorbeelden van redoxreacties in het dagelijks leven zijn:
methaanverbranding
CH4(g) + 2O2(g) → CO2(g) + 2H2O(v)
Fotosynthese
6CO2(g) + 6H2O(v) → C6H12O6(hier) + 6O2(g)
ijzercorrosie
2Fe(s) + 3/4O2(g) + 3 uur2O(v) → 2Fe (OH)3(en) (roest Fe2O3.3H2O)
Leer meer over oxidatiegetal (nox).
Hoe verlopen oxidatie- en reductiereacties?
De vergelijking van de redoxreactie met koper en zink kan worden weergegeven door halfreacties, zoals hieronder weergegeven.
- oxidatie halfreactie: Zn0(s) → 2e- + Zn2+(hier)
- Reductie halfreactie: kont2+(hier) + 2e- → kont0(s)
- globale vergelijking: Zn0(s) + kont2+(hier) → Zn2+(hier) + kont0(s)
Deze elektronenoverdracht in de redoxreactie vindt plaats volgens het reductiepotentieel van de betrokken soort. De component met de laagste reductiepotentiaal heeft de neiging om elektronen af te staan, terwijl de component met de hoogste potentiaal deze ontvangt.
Zo heeft zink een reductiepotentieel van -0,76V, terwijl koper een reductiepotentiaal heeft van +0,34V. Daarom is zink, omdat het een lager reductiepotentieel heeft, een beter reductiemiddel en bevordert het de reductie koper, dat een hoger reductiepotentieel heeft en daarom elektronen opneemt en zinkoxidatie veroorzaakt.
Lees ook over redoxreacties.
Oefeningen over oxidatie en reductie
Gebruik de volgende vragen om uw kennis te testen van wat u in deze tekst hebt geleerd.
vraag 1
Met betrekking tot oxidatie- en reductiereacties is het correct om te stellen dat:
a) De toename van de NOx van de chemische soort geeft aan dat deze een afname heeft ondergaan.
b) De stof die elektronen verliest, ondergaat oxidatie en is een oxidatiemiddel.
c) Bij redoxreacties worden elektronen overgedragen.
d) De stof die elektronen opneemt, wordt gereduceerd en is een reductiemiddel.
e) De afname van de NOx van de chemische soort geeft aan dat deze oxidatie heeft ondergaan.
Correct alternatief: c) Bij oxidatie-reductiereacties vindt elektronenoverdracht plaats.
Bij redoxreacties worden elektronen overgedragen.
De stof die elektronen opneemt, ondergaat reductie en is het oxidatiemiddel. De afname van de NOx van de chemische soort geeft aan dat deze is verminderd.
De stof die elektronen verliest, ondergaat oxidatie en is een reductiemiddel. De toename van de NOx van de chemische soort geeft aan dat het oxidatie heeft ondergaan.
vraag 2
Voorbeelden van redoxreacties in het dagelijks leven BEHALVE
a) Corrosie
b) verbranding
c) Fotosynthese
d) Neutralisatie
Verkeerd alternatief: d) Neutralisatie.
Een neutralisatiereactie is er een die optreedt tussen een zuur en een base, wat resulteert in zout en water. Bijvoorbeeld:
NaOH + HCl → NaCl + H2O
Voorbeelden van een redoxreactie zijn:
methaanverbranding
CH4(g) + 2O2(g) → CO2(g) + 2H2O(v)
Fotosynthese
6CO2(g) + 6H2O(v) → C6H12O6(hier) + 6O2(g)
ijzercorrosie
2Fe(s) + 3/4O2(g) + 3 uur2O(v) → 2Fe (OH)3(en)
vraag 3
Bekijk de volgende oxidatie-reductiereacties en geef aan welke de oxidatie- en reductiemiddelen zijn.
L. Zn0(s) + kont2+(hier) → Zn2+(hier) + kont0(s)
II. kont2+(hier) + H2(g) → 2H+(hier) + kont(s)
III. Zn(s) + 2H+(hier) → Zn2+(hier) + H2(g)
Antwoord:
In een redoxreactie is degene die oxidatie ondergaat het reductiemiddel en degene die reductie ondergaat is het oxidatiemiddel.
L. Zn0(s) + kont2+(hier) → Zn2+(hier) + kont0(s)
Oxidatiemiddel: koper (Cu)
Reductiemiddel: zink (Zn)
II. kont2+(hier) + H2(g) → 2H+(hier) + kont(s)
Oxidatiemiddel: koper (Cu)
Reductiemiddel: waterstof (H)
III. Zn(s) + 2H+(hier) → Zn2+(hier) + H2(g)
Oxidatiemiddel: waterstof (H)
Reductiemiddel: zink (Zn)
Meer kennis opdoen met de inhoud:
- Wat zijn stapels?
- elektrochemie
- elektrolyse
Bibliografische verwijzingen
FONSECA, M. R. M Chemie, 2. 1. red. Sao Paulo: Attika, 2013.
SANTOS, W.L.P; MOL, GS Burgerchemie, 3. 2. red. Sao Paulo: Editora AJS, 2013.
USBERCO, J. Verbind chemie, 2: chemie. - 2. red. Sao Paulo: Saraiva, 2014.


