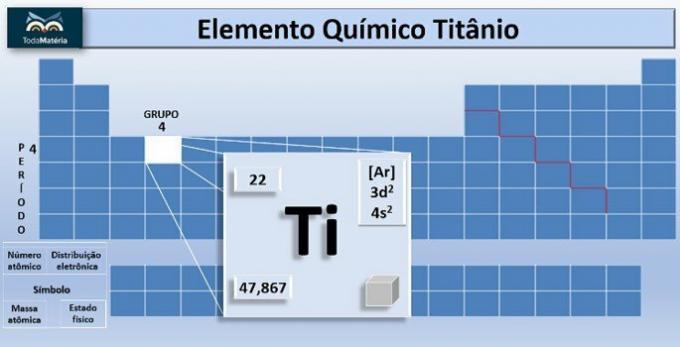
O titanium is het scheikundige element met symbool Ti en atoomnummer, dat wil zeggen, aantal protonen gelijk aan 22. Dit metaal bevindt zich in groep 4 en 4 van het periodiek systeem.
De atomaire massa van het element is 47,867 u, en omdat het 22 elektronen in de elektronen van het atoom heeft, is de elektronenverdeling 1s2 2s2 2p6 3s2 3p6 4s2 3d2.
Titanium heeft gewenste eigenschappen voor tal van toepassingen omdat het zo sterk is als staal en veel lichter.
Omdat het een ductiel, vuurvast, corrosiebestendig metaal is, biedt het mechanische weerstand, thermische stabiliteit en lage reactiviteit, het wordt toegevoegd aan metaallegeringen zodat ze een hoge prestatie. De biocompatibiliteit en niet-toxiciteit maken het ook nuttig voor het maken van botprothesen.
De belangrijkste kenmerken van titanium zijn:
- Smeltpunt: 1668 °C
- Kookpunt: 3287 °C
- Dichtheid: 4,5 g/cm3
- Kleur: zilvergrijs
- Fysische toestand bij 20 °C: vast
- Isotopen: Ti46, jij47, jij48, jij49 en jij50
Dit scheikundige element werd in 1791 ontdekt door de Engelsman William Gregor en de naam is afgeleid van het Grieks
titanen, werd later toegeschreven door Martin Heinrich Klaproth.Titanium is het negende meest voorkomende element op aarde en wordt in de aardkorst aangetroffen in ertsen zoals rutiel (TiO2) en ilmeniet (FeTiO3). Daarom is mijnbouw de belangrijkste methode om dit metaal te verkrijgen.
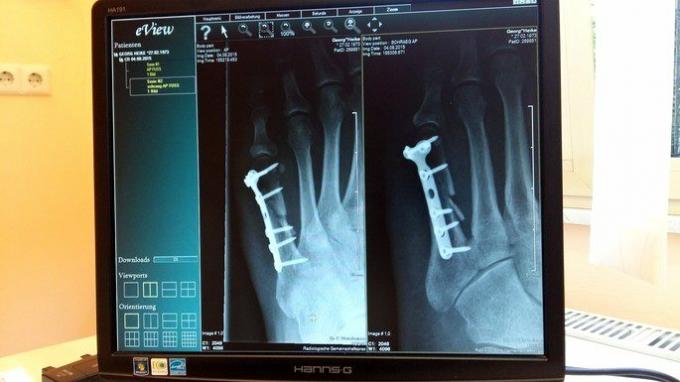
Waar wordt titanium voor gebruikt?
Omdat het bij kamertemperatuur chemisch niet-reactief is, gemakkelijk te vormen, een hoge mechanische en corrosieweerstand heeft, wordt titanium gebruikt als een strategisch metaal.
De luchtvaart- en ruimtevaartindustrie zijn de belangrijkste gebruikers van titanium voor de productie van onderdelen, zoals turbine- en rompcomponenten. Andere toepassingen zijn de vervaardiging van tandprothesen, chirurgische implantaten en sieraden.
In de geneeskunde is titanium erg handig vanwege de compatibiliteit met menselijke weefsels, lichtheid en kracht. Het wordt gebruikt voor de productie van implantaten voor lichaamsdelen, zoals fixatieschroeven, kniegewrichtvervanging, opperarmbeenprothese, heupprothese, enz.
Titaandioxide (TiO2) is een van de belangrijkste verbindingen van dit element en wordt gebruikt als bleekmiddel. Over het algemeen gebruiken witte inkten van hoge kwaliteit het om het uiterlijk van kleur en glans te verbeteren. Ook andere producten, zoals tandpasta's en zonnefilters, gebruiken het pigment. Er is ook toepassing als kleurstof voor levensmiddelen toegevoegd in zuivelproducten, snoep en dranken.
In de architectuur zien we het gebruik van titanium om gebogen structuren te bedekken in het Guggenheim Museum in Bilbao, Noord-Spanje.

In het dagelijks leven vinden we tal van producten die titanium in hun samenstelling hebben, zoals fietsframes, brillen en tennisrackets.
In de chemische industrie wordt titanium gebruikt als katalysator voor reacties. Op deze manier is het mogelijk om de reactiesnelheid te regelen en de tijd voor productvorming te verkorten zonder de samenstelling van de stoffen te beïnvloeden.
De auto-industrie heeft de integratie van titanium in de productie van auto's bestudeerd om hun massa te verminderen en zo het brandstofverbruik te verminderen en hun acceleratie te vergroten.
Meer kennis opdoen met de inhoud:
- Chemische elementen
- Periodiek systeem
- Wat zijn metalen?
Bibliografische verwijzingen
ATKINS, P.W.; JONES, L. Principes van de chemie: het moderne leven en het milieu in vraag stellen. 3.ed. Porto Alegre: Bookman, 2006.
FELTRE, R. Grondbeginselen van de chemie: vol. enkel. 4e druk. So Paulo: Moderna, 2005.
Leen, J. D. Niet zo beknopte anorganische chemie. Vertaling van de 5e druk. Engels. Uitgever Edgard Blucher Ltd. 1999.
