DE nihonium, atoomnummer 113 en symbool Nh, is een scheikundig element dat behoort tot groep 13 van het periodiek systeem. Bovendien is het een superzwaar element dat niet in de natuur voorkomt. Het verkrijgen ervan kan dus alleen kunstmatig worden gedaan, door middel van kernfusiereacties. De chemische eigenschappen van nihonium zijn nog steeds onduidelijk, maar er wordt gespeculeerd dat het zich in sommige gevallen op dezelfde manier gedraagt als zijn lichtere tegenhanger, thallium.
Nihonium werd aanvankelijk verkregen door te smelten 70Zn met de 209Bi, aan het Riken Institute, Japan, in 2003. Hoewel Russische en Amerikaanse wetenschappers ook vroegen om erkend te worden als ontdekkers van element 113, erkende IUPAC de Japanse wetenschappers. De naam verwijst naar het woord Nihon, zoals de Japanners hun geboorteland noemen.
Lees ook: Gallium — een ander chemisch element dat behoort tot groep 13 van het periodiek systeem
Onderwerpen in dit artikel
- 1 - Samenvatting over nihonium
- 2 - Eigenschappen van nihonium
- 3 - Kenmerken van nihonium
- 4 - Het nihonium verkrijgen
- 5 - Geschiedenis van Nihônio
- 6 - Opgeloste oefeningen op nihonium
samenvatting over nihonium
Het is een synthetisch chemisch element in groep 13 van de Periodiek systeem.
De productie begon in 2003, in het Riken Institute, Japan.
Het vormt de groep elementen die het meest recentelijk in het periodiek systeem zijn opgenomen, in 2015.
Zijn studies zijn nog zeer recent, maar sommigen proberen het te koppelen aan andere elementen van groep 13, zoals thallium.
De productie ervan is: Kernfusie, met behulp van isotopen van 70Zn en atomen van 209Bi.
Niet stoppen nu... Er is meer na de advertentie ;)
Nihonium eigenschappen
Symbool: nah
Atoom nummer: 113
Atoom massa: tussen 278 en 286 c.u. (onofficieel door Iupac)
Elektronische configuratie: [Rn] 7s2 5f14 6d10 7p1
Meest stabiele isotoop:286Nh (9,5 seconden van halveringstijd, die met 6,3 seconden kan toenemen of met 2,7 seconden kan afnemen)
Chemische reeks: groep 13, superzware elementen
kenmerken van nihonium
Nihonium, symbool Nh en atoomnummer 113, was een van de laatste elementen in het periodiek systeem. De officialisatie vond plaats op 30 december 2015 door de International Union of Pure and Applied Chemistry (IUPAC), terwijl de naam pas medio 2016 officieel werd gemaakt.
Elementen in dit gebied van het periodiek systeem zijn zeer onstabiel, wat betekent dat ze niet in de natuur kunnen worden gevonden. Dus, in het licht van een vermeend bestaan, zouden ze bijna onmiddellijk radioactief verval ondergaan - de emissie van nucleaire deeltjes, zoals α en β - om meer stabiliteit te bereiken.
Wanneer ze echter kerndeeltjes uitstoten, ondergaan ze een nucleaire transmutatie, dat wil zeggen dat ze een nieuw chemisch element worden. Zo moeten superzware elementen, zoals Nh, in het laboratorium worden geproduceerd, wat het een synthetisch chemisch element.
Nh wordt, net als andere superzware elementen, beïnvloed door relativistische effecten — op een eenvoudige manier, afstanden van wat wordt waargenomen tot wat werd verwacht, vanwege de relativiteitstheorie. Zo wezen wiskundige studies op theoretisch gebied, die de gevolgen van het relativistische effect simuleren, erop dat nihonium kan zwak interageren met kwarts, maar hebben goede adsorptie aan goud, net als zijn lichtere tegenhanger, thallium (Tl).
Voorlopige theoretische studies gaven ook aan dat: wisselvalligheid van Nh. Wat de adsorptie aan kwarts betreft, vormt thallium bijvoorbeeld gemakkelijk TlOH en wordt vermoed dat nihonium hetzelfde doet.
Toch, hoe? studies zijn nog zeer voorlopig en recent, veel van wat is geproduceerd staat open voor discussie, en het is moeilijk om de fysisch-chemische eigenschappen van nihonium nauwkeurig te bepalen.
Het Nihonium verkrijgen
Element 113 is tot op heden op twee manieren verkregen: via koude fusiereacties, met de fusie van zink (Zn, Z = 30) met bismut (Bi, Z = 83), en ook door de alfa-verval van element 115.
In het eerste voorbeeld is de zink wordt versneld tot 10% van de lichtsnelheid, om de afstotende krachten van de twee kernen te overwinnen. Er wordt dan een isotoop geproduceerd 279Nh, die uiteindelijk een neutron uitstraalt en de. produceert 278Nr.

Met een halfwaardetijd van ongeveer 34 milliseconden is de isotoop 278Nh ondergaat zes alfa-verval (alfadeeltjesemissies) tot het element mendelevium (Md).
In het tweede geval ontstaat element 113 uit het alfaverval van element 115 (nu bekend als muscovium) nadat het is gesynthetiseerd. Een manier is de hete fusiereactie van ionen 48Ca met isotopen 243ah, het produceren van de 288Mc en dan, door alfaverval, de 284Nh, dat alfaverval blijft ondergaan.
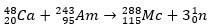
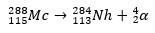
Zie ook: Hassium — het zwaarste synthetische chemische element waarvan de eigenschappen zijn geanalyseerd
geschiedenis van nihonium
De zoektochten naar element 113 begonnen in 2003. Japanse onderzoekers van het Riken Institute versnelden isotopen van 70Zn bij 10% van de lichtsnelheid om te botsen met de 209Bi, door een fusiereactie. Zo slaagden ze erin om te produceren wat we nu kennen als: 278Nr.
Het was echter pas in 2012 dat Japanse onderzoekers konden de volledige reeks van alfaverval detecteren van element 113, contact opnemen met IUPAC om de ontdekking te claimen.
Gelijktijdig met Japanse inspanningen, Russische wetenschappers onder leiding van Yuri Oganessian, in samenwerking met Amerikaanse wetenschappers kwamen ook om het element 113 te identificeren door middel van alfa-verval van het element 115. Dergelijke experimenten brachten ook Russische en Amerikaanse wetenschappers in de strijd voor erkenning van element 113.

IUPAC vond het bewijs van het Riken-instituut echter meer solide, en gaf de Japanners dus het recht om element 113 te noemen. De gekozen naam was nihônio, symbool Nh, in verwijzing naar het land Japan. Het woord Japan is door de Japanners geschreven met behulp van twee Chinese karakters die "land van de rijzende zon" betekenen en worden gelezen als Nihon of Nippon.
De naam nihonium werd ook gekozen omdat de Japanse chemicus Masataka Ogawa in 1908 publiceerde dat had element 43 ontdekt en noemde het Japans, symbool Np (dat tegenwoordig tot neptunium behoort, Z = 93). Later werd echter bewezen dat element 43 onstabiel was, niet in de natuur werd gevonden en pas in 1937 werd gesynthetiseerd, met de naam technetium (Tc).
Zo verdween het Japans uit het periodiek systeem. Jaren later werd echter bewezen dat Ogawa in feite element 75 had ontdekt (nu bekend als rhenium). Tegen die tijd was het element rhenium echter al officieel ontdekt in 1925 en gedoopt.
Opgeloste oefeningen op nihonium
vraag 1
Nihonium, symbool Nh en atoomnummer 113, is een scheikundig element dat vanwege zijn korte halfwaardetijd niet in de natuur voorkomt. De meest duurzame van hen, de 286Nh, heeft ongeveer 9,5 seconden. Wetende dat de halfwaardetijd de tijd is die nodig is om het aantal soorten te halveren, hoeveel seconden duurt het voordat de hoeveelheid van de bovenstaande isotoop 1/16 van de hoeveelheid is? voorletter?
A) 9.5
B) 19
C) 28.5
D) 38
E) 47,5
Oplossing:
alternatief D
Elke 9,5 seconden daalt de hoeveelheid isotoop met de helft. Dus na 9,5 seconden is het bedrag de helft van het oorspronkelijke bedrag. Nog eens 9,5 seconden, in totaal 19 seconden, het aantal daalt weer met de helft en bereikt 1/4 van de initiaal.
Na 28,5 seconden, na nog een halveringstijd, daalt de hoeveelheid weer met de helft, tot 1/8 van de oorspronkelijke hoeveelheid. Eindelijk, na 38 seconden, daalt het bedrag weer met de helft en bereikt het 1/16 van het oorspronkelijke bedrag, zoals gevraagd in het overzicht. De benodigde tijd is dus 38 seconden.
vraag 2
In 2003 begon de zoektocht naar element 113 in het Riken Institute in Japan. In die tijd waren wetenschappers in staat om de 278Nh door de fusie van zink- en bismutatomen.
Hoeveel neutronen zitten er in de genoemde isotoop?
A) 113
B) 278
C) 391
D) 170
E) 165
Oplossing:
alternatief E
Het aantal neutronen kan worden berekend als:
A = Z + n
waarbij A het aantal is van pasta atomair, Z is het atoomnummer en n is het aantal neutronen. Als we de waarden substitueren, hebben we:
278 = 113 + n
n = 278 - 113
n = 165
Door Stefano Araújo Novais
Scheikundeleraar
