DE oganesson, symbool Og, atoomnummer 118, is tot nu toe het chemische element met het hoogste atoomnummer in het periodiek systeem. Het kan niet in de natuur worden gevonden en de productie ervan is kunstmatig, dus het wordt als een synthetisch element beschouwd. Toch is de productie ervan erg moeilijk en wordt het beschouwd als een zeer zeldzaam element, omdat het maar heel weinig is gesynthetiseerd.
Ondanks dat je in dezelfde groep zit als de edelgassenoganesson heeft volgens de berekeningen niet veel kenmerken die naar deze elementen verwijzen wiskundigen demonstreren, als gevolg van de relativistische effecten die superzware elementen ondergaan.
Element 118 werd voor het eerst gesynthetiseerd in 2002, door de reactie van ionen 48Ca met atomen van 249Zie je wel De naam is een eerbetoon aan de Russische wetenschapper Yuri Oganessian, een van de meest gerespecteerde en erkende op het gebied van superzware elementen.
Zie ook: Rutherfordium - het synthetische chemische element genoemd naar wetenschapper Ernest Rutherford
Samenvatting op oganesson
Oganessone is een synthetisch chemisch element in groep 18 van de Periodiek systeem.
Het werd voor het eerst gesynthetiseerd in 2002, in een gezamenlijk werk van Russische en Amerikaanse wetenschappers.
Het vormt de groep elementen die het meest recentelijk in het periodiek systeem zijn opgenomen, in 2016.
Het is een zeer zeldzaam element, dat zeer weinig is gesynthetiseerd.
Hun studies zijn nog zeer recent en de basiseigenschappen worden nog bepaald door berekeningen en wiskundige modellen.
Voorlopige theoretische tests geven aan dat, ondanks het feit dat ze tot de groep van edelgassen behoren, sommige eigenschappen Og van de andere elementen verwijderen.
De aanmaak van oganessone vindt plaats door: Kernfusie, met behulp van ionen van 48Ca en atomen van 249Zie je wel
De naam is een eerbetoon aan de Russische wetenschapper Yuri Oganessian, een van de belangrijkste op het gebied van studie van superzware elementen.
eigenschappen van oganesson
Symbool: oh
Atoom nummer: 118.
Atoom massa: 294 cu (onofficieel door Iupac).
Elektronische configuratie: [Rn] 7s2 5f14 6d10 7p6.
Meest stabiele isotoop: 294Og (0,69 milliseconde halfwaardetijd, die kan worden verhoogd met 0,64 milliseconden of verminderd met 0,22 milliseconden).
Chemische serie: groep 18, superzware elementen, edelgassen.
Kenmerken van oganesson
Oganesson is de hoogste atoomnummerelement (118) tot nu toe officieel gemaakt door de International Union of Pure and Applied Chemistry (IUPAC). Hoewel het voor het eerst werd geproduceerd in 2002, er is weinig over hem bekend. Er wordt nog veel gespeculeerd, omdat dit element niet in de natuur voorkomt. De productie wordt uitgevoerd in het laboratorium, dat het configureert als een synthetisch element.
Verder, uw halveringstijd is minder dan een milliseconde (10-3 tweede) — onthouden dat de halfwaardetijd de tijd is die nodig is om de hoeveelheid te halveren. Daarom zijn de eigenschappen die voor dit element worden bepaald niets anders dan de resultaten van theoretische berekeningen op basis van wiskundige modellen, omdat in het gebied van het periodiek systeem waarin het zich bevindt vindt de relativistische effecten (de discrepantie tussen verwachte en waargenomen effecten als gevolg van relativiteit) significant zijn.
Relativistische effecten leiden Og af van wat er van hem werd verwacht. Het bestanddeel, bijv. heeft geen vergelijkbaar gedrag als edelgassen. Berekeningen tonen aan dat oganesson een vaste stof zou zijn bij kamertemperatuur, met een smeltpunt in het bereik van 325 ± 15 K (ongeveer 52 °C) en een kookpunt in het bereik van 450 ± 10 K (ongeveer 177 °C).
Het is ook bekend dat Og reactiever kan zijn dan andere edelgassen, omdat het door relativistische effecten gemakkelijker p-subniveau-elektronen kan verliezen. Een ander punt van onenigheid met de edelgassen is dat oganessone een halfgeleider, terwijl de andere isolatoren zijn.
Lees ook: Waterstof — het chemische element met het laagste atoomnummer in het periodiek systeem
Het verkrijgen van oganesson
Net als andere superzware elementen, wordt oganesson verkregen door middel van een techniek genaamd de hotmelt, waar ionen van de isotoop 48Ca, dat van nature voorkomt maar zeer weinig beschikbaar is, reageert met veel zwaardere isotopen om de superzware elementen te produceren.
Og is zo'n zeldzaam en moeilijk te verkrijgen element dat In tien jaar tijd slechts vier atomen kwam om te worden geproduceerd. Kortom, de productie van 294Og, de enige bekende isotoop, ontstaat door bombardement van ionen 48Ca tot een kern van 249Zie, met het vrijkomen van 3 neutronen.
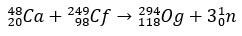
Met een halveringstijd van enkele milliseconden, de Og werd geïdentificeerd door zijn vervalpatroon, iets heel gebruikelijks voor superzware elementen. In dit geval vonden 3 alfa-verval plaats, waardoor element 118 copernicium, Cn, werd, dat uiteindelijk spontane splijting onderging.
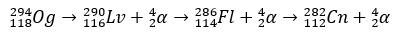
geschiedenis van oganesson
De eerste synthese van oganessone vond plaats in 2002., in de stad Livermore, Californië, Verenigde Staten, in het Lawrence Livermore National Laboratory, waar een groep Amerikaanse wetenschappers werkte samen met Russische onderzoekers van het gevierde Joint Institute for Nuclear Research (JINR), geleid door de Russische wetenschapper Yuri Oganessian.
In een periode van tien jaar sinds de eerste synthese werden slechts vier atomen van oganesson gesynthetiseerd, vanwege de zeldzaamheid en moeilijkheid van de reactieparameters. Het vierde en laatste atoom was echter een ongelooflijke ontdekking.
Wetenschappers probeerden element 117 te synthetiseren door de reactie van 48Ca met de 249Bk, maar het werd opgemerkt dat 28% van het berkelium-doel een β-verval onderging, omgezet in 249Zie en dus genererend element 118. het is opmerkelijk dat de naam van element 118 eert de Russische wetenschapper Yuri Oganessian, een eerbetoon dat voor levende scheikundigen slechts twee keer is voorgekomen in de geschiedenis van de scheikunde, de eerste was aan Glenn Seaborg, met de zeeborgium.
Opgeloste oefeningen op oganesson
vraag 1
Oganessone, element met atoomnummer 118 en symbool Og, werd in de zevende periode van het Periodiek Systeem geplaatst, in de groep edelgassen. Als gevolg hiervan is er veel gespeculeerd over de vraag of een dergelijk element grote stabiliteit zou bieden, een kenmerk dat bekend is bij de andere elementen van deze groep. De toewijzing van Og in groep 18 was te wijten aan:
A) dit element is zeer stabiel.
B) dit element heeft acht elektronen in zijn valentieschil.
C) dit element is aantoonbaar een gas bij kamertemperatuur.
D) dit element heeft dezelfde chemische eigenschappen als de andere edelgassen.
E) dit element heeft een hoge ionisatie-energie.
Oplossing:
alternatief B
De toewijzing van de Og vindt uitsluitend en uitsluitend plaats op grond van zijn elektronische distributie. Het feit dat het acht elektronen heeft valentie laag, 7s2 7p6, plaatst het in die positie. Studies met dit element zijn nog voorlopig, maar op basis van wiskundige resultaten wordt al gespeculeerd dat Og bijvoorbeeld bij kamertemperatuur geen gas is. Een ander punt dat moet worden benadrukt, is dat Og helemaal niet stabiel is, zelfs niet in de natuur bestaat.
vraag 2
De grote moeilijkheid bij het produceren van element 118 wekt het idee op dat wetenschappers op een ware odyssee waren om het te kunnen detecteren. Geen wonder, na tien jaar van zijn eerste synthese, werd oganesson nog maar drie keer gesynthetiseerd. En tot nu toe is er maar één isotoop bekend, de 294oh Hoeveel neutronen heeft de bekende isotoop van oganesson?
een) 294.
B) 118.
C) 176.
D) 412.
E) 166.
Oplossing:
alternatief C
Het aantal neutronen van Og kan als volgt worden berekend:
A = Z + n
A is het aantal pasta atomair, Z is het aantal protonen (of atoomnummer) en n is het aantal neutronen. Als we de waarden substitueren, hebben we:
294 = 118 + n
n = 294 - 118
n = 176
Door Stefano Araújo Novais
Scheikundeleraar
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/oganessonio-og.htm
