DE hassium, met symbool Hs en atoomnummer 108, is een van de elementen die bekend staat als transactiniden. Zoals alle elementen van deze groep wordt het niet in de natuur gevonden, omdat het synthetisch is, maar ook radioactief en onstabiel is. De synthese ervan wordt toegeschreven aan de Duitse laboratoria van het Helmholtz Center for Research on Heavy Ions (GSI), in de stad van Darmstadium, Duitsland, en zijn naam werd gegeven ter ere van de Duitse deelstaat Hessen, gelegen in de centrale regio van de ouders.
Hassium is het zwaarste element waarvan de eigenschappen zijn geanalyseerd, door middel van experimenten die door de GSI zelf zijn uitgevoerd. De resultaten waren belangrijk om de positie van Hs in de Periodiek systeem, omdat de gelijkenis tussen dit element en osmium en ruthenium, lichtere elementen van groep 8, werd waargenomen.
Lees ook:Bohrium - het synthetische chemische element vernoemd naar Niels Bohr
Hassium-samenvatting
Het is een synthetisch chemisch element in groep 8 van het periodiek systeem.
Het werd gesynthetiseerd door de Gesellschaft für Schwerionenforschung (GSI) in Darmstadium, Duitsland.
Het is een radioactief element en onstabiel.
Theoretische en experimentele gegevens bevestigen dat de eigenschappen lijken op de lichtste elementen van zijn groep.
Als transactinide kan het niet op grote schaal worden geproduceerd, behalve dat het met een snelheid van enkele wordt geproduceerd atomen.
Niet stoppen nu... Er is meer na de advertentie ;)
Hassium-eigenschappen
Symbool: hs
Atoom nummer: 108
Atoom massa: 277 cu
Elektronische configuratie: [Rn] 7s2 5f14 6d6
Meest stabiele isotoop: 269Hs (14 tweede halfwaardetijd)
Chemische reeks: groep 8; transactiniden; superzware elementen.
Hassium-functies
Hassium is een synthetisch element en de zwaarste van groep 8. Het wordt beschouwd als een transactinide, juist omdat het in het Periodiek Systeem verschijnt na de actinidereeks. Zoals alle transactiniden is hassium een element radioactief en onstabiel.
Dit betekent dat zijn isotopen weinig tijd van halveringstijd (de tijd die nodig is om de massa van de atoomsoort te halveren). Momenteel zijn er zeven isotopen van hassium bekend, waarvan de massa varieert van 264 uur 's ochtends tot 270 uur 's ochtends. Van alle is de meest stabiele isotoop 269Hs, met een halfwaardetijd van 14 seconden.
Hoewel de korte halfwaardetijd het moeilijk maakt om de chemische eigenschappen van transactiniden te bestuderen, heeft hassium in dit opzicht iets meer geluk gehad. In juni 2001 werd bekend dat hij was geworden het zwaarste element waarvan de eigenschappen geanalyseerd moeten worden.
Een team slaagde erin om in de stad Darmstádio, Duitsland, ongeveer zes Hs-atomen te produceren met een halfwaardetijd van ongeveer 10 seconden. Hoewel het weinig lijkt, was dit voldoende om te bevestigen dat het hassiumoxide, HsO4, heeft sterke overeenkomsten met de oxiden van de lichtere elementen van groep 8, RuO4 en OsO4, dat is de ruthenium het is de osmium.
Zie ook: Seaborgium — een ander synthetisch chemisch element met radioactieve eigenschappen en een korte halfwaardetijd
Hassium verkrijgen
Transactiniden hebben gemeen dat ze moeilijk te produceren zijn. Over het algemeen is state-of-the-art apparatuur vereist, zoals: deeltjesversnellers. Hierin botsen ionische soorten met elementen van hoge atoom massa om de superzware elementen te vormen (waarin Hs is opgenomen).
In het geval van hassium hadden de onderzoeken die zijn positie in groep 8 van het periodiek systeem bevestigden, betrekking op de productie ervan door het bombardement van magnesium-26, met curium-248 als doelwit.
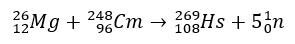
Experimenten met deze elementen zijn duur en daarom is het gebruikelijk dat theoretische studies worden uitgevoerd, juist om chemische eigenschappen te berekenen en te voorspellen. De korte halfwaardetijd is een andere complicerende factor.
De experimentele technieken van scheiding en detectie moet zeer snel zijn om geloofwaardige resultaten te verkrijgen. Ten slotte is de reactie-efficiëntie van deze elementen zeer laag, in het bereik van enkele atoomeenheden.
Voorzorgsmaatregelen met Hassium
Hs wordt niet op grote schaal geproduceerd en daarom wordt het gemanipuleerd brengt geen risico's met zich mee. Bovendien wordt het verkregen in onderzoekscentra met sterk gecontroleerde omgevingen.
geschiedenis van hassium

De transactiniden waren protagonisten van een wetenschappelijk geschil vanwege de Koude Oorlog, a Oorlog van overdrachten, een naam bedacht in verwijzing naar de geschillen die betrekking hadden op de productie en erkenning van elementen na fermium (Fm, Z = 100). Bij deze race waren de laboratoria betrokken:
Gemeenschappelijk Instituut voor Nucleair Onderzoek, in de stad Dubna, Rusland;
Lawrence Berkeley National Laboratory in Berkeley, Californië;
Gesellschaft für Schwerionenforschung (GSI, beter vertaald als Helmholtz Center for Research on Heavy Ions) in Darmstadium, Duitsland.
In het geval van element 108 waren de groepen GSI en Dubna erbij betrokken. Hoewel de Dubna-wetenschappers (onder leiding van Yuri Oganessian) voor het eerst de aanwezigheid van element 108 rapporteerden, eisten die van de Duitse groep de eer op, aangezien de GSI presenteerde meer overtuigende resultaten, terwijl hij in één experiment drie atomen van de isotoop 265 wist te produceren, terwijl hij in een ander experiment één atoom van de isotoop 264 produceerde.
Deze isotopen werden geproduceerd met behulp van de Universal Linear Accelerator (Unilac, beter vertaald als Universal Linear Accelerator), met beschieting van de 208Pb door 58Vertrouwen. In 1997 erkende de International Union of Pure and Applied Chemistry (IUPAC) element 108, met symbool Hs, als Hassium ter ere van de Duitse deelstaat Hessen.
Oefeningen opgelost op hassium
vraag 1
Hassium, symbool Hs, wordt beschouwd als het zwaarste element waarvan de eigenschappen experimenteel zijn bestudeerd. Destijds konden onderzoekers de eigenschappen van hasiumtetroxide, HsO., bepalen4. Bij deze soort heeft Hs dezelfde NOx als de lichtere elementen van zijn groep, osmium (Os) en ruthenium (Ru). Het oxidatiegetal van Hs in hasiumtetroxide is gelijk aan:
a) 0
B) +2
C) +4
D) +6
E) +8
Oplossing:
alternatief E
DE zuurstof, wanneer in een oxyde, krijgt een lading gelijk aan -2. Dus de NOx van Hs, die we x zullen noemen, kan worden berekend als:
x + 4(-2) = 0
x - 8 = 0
x = +8
vraag 2
De meest stabiele isotoop van hassium, Hs, heeft een halfwaardetijd van slechts 14 seconden. Dat betekent:
A) over 14 seconden is de massa van de isotoop van Hs verdubbeld.
B) na 14 seconden zal de massa van de Hs-isotoop minder zijn dan de helft van de oorspronkelijke massa.
C) in iets minder dan een minuut zal de massa van de Hs-isotoop 1/16 van zijn oorspronkelijke massa zijn.
D) in één minuut zal de massa van de Hs-isotoop precies de helft zijn van zijn oorspronkelijke massa.
E) in 14 seconden wordt de massa van de Hs-isotoop gedeeld door 4.
Oplossing:
alternatief C
De halfwaardetijd geeft de tijd aan die nodig is om de hoeveelheid atoomsoorten te halveren. Dit betekent dat elke 14 seconden de hoeveelheid Hs met de helft daalt. Door deze halfwaardetijd waar te nemen, is het duidelijk dat met 56 seconden al vier halfwaardetijden zijn bereikt, waardoor de massa van Hs wordt gedeeld door 2.4, dat is 16.
Door Stefano Araújo Novais
Scheikundeleraar
