DE periodieke classificatie van elementen werd in 1913 voorgesteld door Henry Monseley (1887-1915), die de periodieke variatie van velen identificeerde eigenschappen met regelmatige tussenpozen volgens het aantal protonen in de kern van het atoom van een element chemisch.
Vanwege de Wet van periodiciteit, is het criterium dat wordt gebruikt om de elementen van het huidige periodiek systeem te ordenen de oplopende volgorde van atoomnummer (Z).
De 118 chemische elementen zijn gerangschikt in groepen en perioden van het periodiek systeem. Volgens de fysische en chemische eigenschappen is het mogelijk om onderscheid te maken tussen: metalen, niet-metalen (niet-metalen) en halfmetalen (metalloïden).

De verticale lijnen zijn de 18 groepen de tafel en brengt elementen met vergelijkbare chemische eigenschappen samen. De horizontale lijnen komen overeen met de 7 periodes en presenteert de elementen met hetzelfde aantal elektronische lagen.
Waterstof is een element dat vanwege zijn elektronische distributie boven groep 1 staat, maar er geen gemeenschappelijke kenmerken mee heeft.
Bekijk de Periodiek systeem compleet en bijgewerkt.
metalen
De meeste chemische elementen in het periodiek systeem zijn geclassificeerd als metalen. De belangrijkste kenmerken van metalen zijn:
- Ze hebben een karakteristieke glans;
- Ze zijn dicht, kneedbaar en kneedbaar;
- Ze zijn goede geleiders van elektriciteit en warmte;
- Ze zijn aanwezig onder omgevingsomstandigheden in vaste toestand, met uitzondering van kwik.
De metalen elementen van het periodiek systeem zijn:
alkalimetalen (groep 1): lithium, natrium, kalium, rubidium, cesium en francium.
aardalkalimetalen (groep 2): beryllium, magnesium, calcium, strontium, barium en radium.
Representatieve zaken, naast de elementen van groepen 1 en 2, zijn: aluminium, gallium, indium, thallium, nion, tin, lood, flerovium, bismut, muscovium en livermorium.
Buitenste overgangsmetalen zijn de elementen die het centrale deel van het periodiek systeem innemen:
- Groep 3: scandium en yttrium.
- Groep 4: titanium, zirkonium, hafnium en rutherfordium.
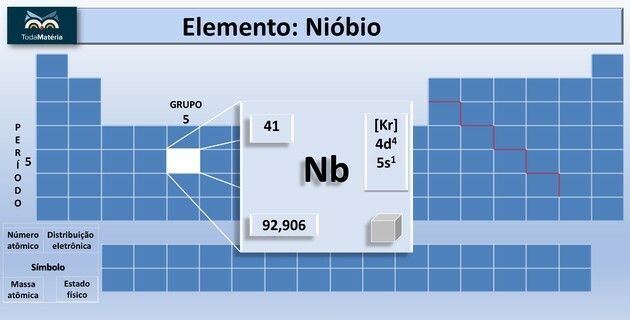
- Groep 5: vanadium, niobium, tantaal en dubnium.
- Groep 6: chroom, molybdeen, wolfraam en seaborgium.
- Groep 7: mangaan, technetium, rhenium en bohrium.
- Groep 8: ijzer, ruthenium, osmium en hassium.
- Groep 9: kobalt, rhodium, iridium en meitnerium.
- Groep 10: nikkel, palladium, platina, darmstadium.
- Groep 11: koper, zilver, goud en röntgen.
- Groep 12: zink, cadmium, kwik en copernicium.
Interne overgangsmetalen zijn de elementen die deel uitmaken van groep 3 en overeenkomen met de elementen van de lanthanide- en actinidereeks.
De lanthanidereeks bestaat uit lanthaan, cerium, praseodymium, neodymium, promethium, samarium, europium, gadolinium, terbium, dysprosium, holmium, erbium, thulium, ytterbium en lutetium.
De actinidereeks bevat de elementen actinium, thorium, protactinium, uranium, neptunium, plutonium, americium, curium, berkelium, californium, einsteinium, fermium, mendelevium, nobelium en laurence.
Lees meer over de alkalimetalen.
niet-metalen
Niet-metalen bevinden zich in het rechterdeel van het periodiek systeem en hebben tegengestelde eigenschappen aan metalen, bijvoorbeeld:
- Ze hebben geen glanzend uiterlijk;
- Ze zijn geen goede geleiders van elektriciteit en warmte, dus worden ze gebruikt als isolatoren;
- Ze hebben een laag kook- en smeltpunt, dus velen worden in de natuur in vloeibare toestand aangetroffen.
Jij niet-metalen elementen van het periodiek systeem zijn: waterstof, stikstof, zuurstof, koolstof, fosfor, selenium, zwavel, halogenen en edelgassen.
Jij halogenen zijn de elementen die tot groep 17 behoren: fluor, chloor, broom, jodium, astatine, tenessine en de edelgasfamilie.
Jij edelgassen zijn de elementen die tot groep 18 behoren: helium, neon, argon, krypton, xenon, radon, oganesson.
Meer informatie over de edelgassen en de halogenen.
halfmetalen
De halfmetalen of metalloïden zijn: boor, silicium, germanium, arseen, antimoon, tellurium en polonium. Deze elementen hebben eigenschappen die tussen metalen en niet-metalen liggen.
Lees ook over de periodiek systeem families.
Representatieve en overgangselementen
Een andere manier om elementen te classificeren is door ze op te delen in representatieve en overgangselementen volgens de elektronische distributie van het atoom.
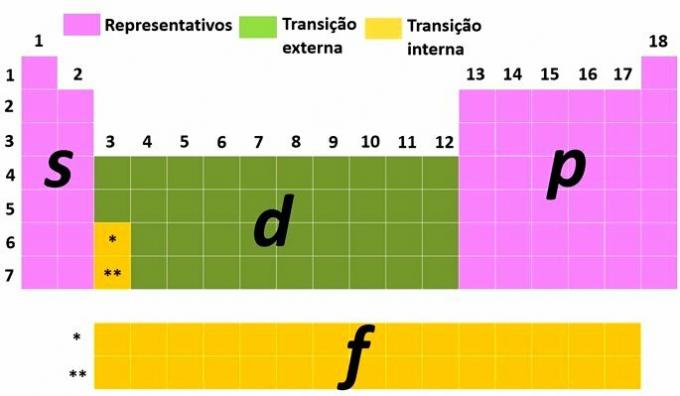
Jij Representatieve elementen zijn degenen die de elektronische configuratie hebben die eindigt met het meest energetische subniveau in s (groepen 1 en 2) of voor (groepen 13, 14, 15, 16, 17 en 18).

Jij overgangselementen zijn gescheiden in externe transitie, met de elementen met het meest energetische elektron op het subniveau D en die van interne transitie, waar het meest energetische elektron zich op een subniveau bevindt F.

Meer kennis opdoen met de inhoud:
- periodieke eigenschappen
- Periodiek Systeem Oefeningen
- Oefeningen over de organisatie van het periodiek systeem