Alcoholen kunnen oxidatie ondergaan wanneer ze worden blootgesteld aan een oxidatiemiddel, zoals een waterige oplossing van kaliumdichromaat (K2Cr2O7) of kaliumpermanganaat (KMnO4) in een zuur medium.
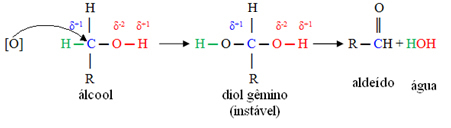
Een ontluikende zuurstof [O] in het midden zal de koolstof aanvallen die is gekoppeld aan de functionele alcoholgroep (hydroxyl - OH), waardoor een zeer onstabiele verbinding wordt gevormd, tweelingdiol genaamd, die twee hydroxylen heeft die aan dezelfde zijn gekoppeld koolstof. Omdat het onstabiel is, geeft deze verbinding water af en ontstaat er een nieuw product.
Dit product is afhankelijk van het type alcohol dat is geoxideerd, of het nu primair, secundair, tertiair of methanol is.
In het kort hebben we:
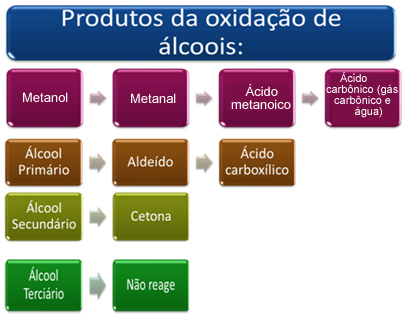
Zie elk geval hieronder:
- Methanol (H3C─ OH):
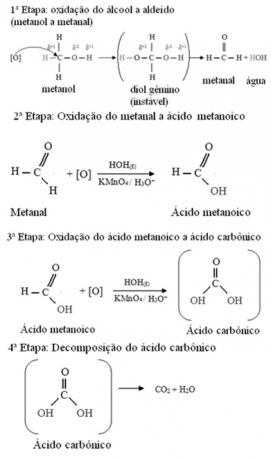
Methanol is de enige alcohol met drie waterstofatomen die aan koolstof zijn gebonden en die oxidatie zullen ondergaan. In dit geval, aangezien er drie punten op het molecuul zijn die een ontluikende zuurstof kan aanvallen, zullen er drie opeenvolgende oxidaties plaatsvinden, zoals weergegeven in het onderstaande diagram:
- Primaire alcoholen:
In deze verbindingen is de hydroxyl-koolstof gebonden aan slechts één koolstofatoom, dat wil zeggen, de twee andere liganden zijn waterstofatomen, en er zijn twee plaatsen waar de ontluikende zuurstof kan aanvallen.
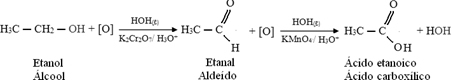
Ten eerste zal er de vorming van een aldehyde zijn, zoals hieronder weergegeven:
Maar de oxidatie gaat door, omdat de reagentia die worden gebruikt om alcohol te oxideren sterker zijn dan die gebruikt om een aldehyde te oxideren. Dan valt een andere ontluikende zuurstof de carbonylkoolstof aan en produceert een carbonzuur.
Het volgende is een voorbeeld, de oxidatie van ethanol, eerst tot ethanal en vervolgens tot ethaanzuur (azijnzuur). Deze totale reactie is de transformatie van wijn in azijn.
Niet stoppen nu... Er is meer na de reclame ;)
Gedeeltelijke oxidatie van ethanol tot ethanal vindt plaats wanneer een alcoholist een wegwerp-ademtest doet. In dit apparaat bevindt zich een vast mengsel van kaliumdichromaat en silica in een zuur medium, waarbij de volgende reactie optreedt:
K2Cr2O7(aq) + 4H2ENKEL EN ALLEEN4(aq) + 3 CH3CH2Oh(G) → Cr2(ENKEL EN ALLEEN4)3(aq) + 7 uur2O(1) + 3 CH3CHO(G) + K2ENKEL EN ALLEEN4(aq)
Oranjeethanol (kleurloos)groenteethanal (kleurloos)
Merk op dat, naast de oxidatie van ethanol (alcohol) tot ethanal (aldehyde), er een gelijktijdige reductie is van dichromaat, dat oranje is, tot chroom (III), of zelfs chroom (II), dat groen is. De kleurverandering geeft aan dat de persoon meer alcohol in het bloed heeft dan toegestaan.
- Secundaire alcoholen:
Dit zijn verbindingen waarin de hydroxyl-koolstof is gebonden aan twee andere koolstofatomen en slechts aan één waterstofatoom. Daarom zal er maar één locatie in het molecuul zijn waar de ontluikende zuurstof kan aanvallen en zal er slechts één type product worden gevormd, wat altijd een keton zal zijn:
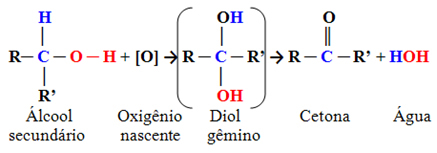
Aangezien aan de carbonylkoolstof van een keton geen waterstof direct is gebonden, is er geen mogelijkheid meer tot verdere oxidatie. Daarom stopt de reactie bij het keton.
- Tertiaire alcoholen:
Tertiaire alcoholen zijn die waarin de koolstof met de -OH-groep drie bindingen maakt met andere koolstofatomen. Omdat ze zich niet binden met waterstofatomen, is er geen punt op het molecuul dat kan worden aangevallen door ontluikende zuurstof. Vanwege dit feit ondergaan tertiaire alcoholen geen oxidatie.
* Bron en auteur van de afbeelding: CostaPPPR.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijk:
FOGAÇA, Jennifer Rocha Vargas. "Oxidatie van alcoholen"; Braziliaanse School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/oxidacao-dos-alcoois.htm. Betreden op 27 juli 2021.
Scheikunde

Hoe de Breathalyzer werkt, alcoholconcentratie, breathalyzer, reacties met ethylalcohol, soorten blaastesten, kaliumdichromaat, brandstofcel, katalysator, elektronenafgifte, azijnzuur, waterstof, conce