| DE diffusie van een gas is een spontane beweging van een gas door een ander gas, dat wil zeggen de verspreiding ervan in een ander gasvormig medium. |
Dit gasmengsel geeft aanleiding tot homogene mengsels of gasvormige oplossingen. Bijvoorbeeld, de gassen die uit fabrieksschoorstenen komen, of auto-uitlaten, verspreiden zich door de lucht atmosferisch en met het verstrijken van de tijd konden we ze niet meer onderscheiden, omdat er een diffusie van deze gassen door de lucht.

De gassen die door de schoorstenen worden uitgestoten, worden verspreid en "verloren" in de atmosferische lucht, omdat het luchtvolume veel groter is dan dat van de rook.
| DE effusie van gassen is een bepaald type diffusie, waarbij er gassen lekken door kleine gaatjes (of poreuze wanden, wat een reeks kleine gaatjes is). |
Ballonnen die aan kinderen worden verkocht, worden bijvoorbeeld gevuld met heliumgas. Na verloop van tijd komt dit gas terecht door de rubberen poriën van de ballon, dat wil zeggen, er is zijn effusie. Dit blijkt uit het feit dat de ballon na enkele uren leegloopt.
Niet stoppen nu... Er is meer na de reclame ;)
De Schotse chemicus Thomas Graham bestudeerde in 1829 dit gedrag van gassen. Hij concludeerde dat de snelheid waarmee een gas in een ander diffundeert of uitstroomt, verband houdt met de dichtheid ervan. Terwijl zijn experimentele gegevens zich voor alle gassen herhaalden, creëerde hij de volgende wet die zijn naam draagt:
De wet van Graham: de diffusie- of effusiesnelheid van een gas is omgekeerd evenredig met de vierkantswortel van zijn dichtheid.
Wiskundig kan deze wet worden uitgedrukt door de vergelijking:
v 
Of, als we twee verschillende gassen met elkaar in verband brengen, hebben we:
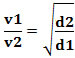
De eenheid die in dit geval wordt gebruikt, is het "volume dat per tijdseenheid ontsnapt"; daarom in het algemeen l/min (liter per minuut).
Zo diffunderen gassen met een lagere dichtheid sneller. Als het in dezelfde temperatuur- en druktoestand is, kun je hier ook een relatie van maken met de massa gasmolair: hoe groter de dichtheid van het gas, hoe groter de molaire massa en hoe lager de snelheid van diffusie; en vice versa. Zo hebben we:
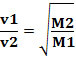
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Brazilië School Team
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijk:
FOGAÇA, Jennifer Rocha Vargas. "Diffusie en effusie van gassen"; Braziliaanse School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/difusao-efusao-dos-gases.htm. Betreden op 27 juli 2021.