Volumetrische analyse of volumetrie het is een laboratoriumprocedure waarbij we een bepaald volume a. gebruiken oplossing in concentratie bekend om de concentratie van een andere oplossing te bepalen. Het volume van de oplossing met bekende concentratie zal worden bepaald wanneer deze volledig reageert met de oplossing met onbekende concentratie, dat wil zeggen dat de betrokken oplossingen met elkaar moeten reageren.
De meest gebruikte instrumenten om een bepaald volume te meten zijn:
- Pipet

Voorbeeld van pipet gebruikt bij volumemeting
- Buret

De buret is een belangrijke volumetrische meetapparatuur
De volumemeting wordt gedaan door de hoogte van de zogenaamde meniscus te evalueren, dat niets meer is dan het oppervlaktegebied van de vloeistof, dat een rechthoekig of koepelvormig aspect (druppelvorm) vertoont, afhankelijk van de dikte van de container. Hoe breder de container, hoe rechthoekiger de meniscus; hoe dunner de container, hoe boller deze zal zijn. Om de meniscus te beoordelen, moet het oog precies op zijn hoogte zijn en moeten we het onderste gebied als referentie gebruiken, als de meniscus rechthoekig is, of de punt, als hij uitpuilt. Bekijk een weergave van een assessment:
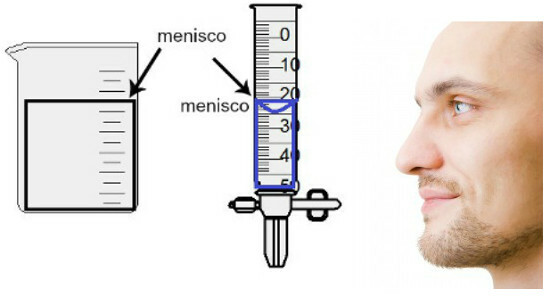
Voor het beoordelen van een meniscus is het belangrijk dat uw ogen er naar toe kijken.
In volumetrische analyse is de meest gebruikte apparatuur de buret. Omdat de methode chemische reacties met zich meebrengt en deze snel kunnen worden verwerkt, maakt de buret het mogelijk de vloeistof komt aan de punt in druppels vrij, waardoor we kunnen voorkomen dat de vloeistof meer naar buiten komt gecontroleerd.
Een van de meest gebruikte procedures binnen de volumetrie is de titratie. Het is een volumetrische analyse waarbij sprake is van het optreden van een reactie tussen een zuur en een base of omgekeerd. De apparatuur die nodig is voor de realisatie ervan wordt weergegeven in de onderstaande afbeelding:
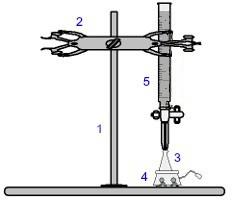
Vertegenwoordiging van de apparatuur die bij een titratie wordt gebruikt
De cijfers in het blauw betekenen:
1) Universele ondersteuning;
2) Klauw (gebruikt om de buret vast te houden);
3) Erlenmeyer (ontvangt de oplossing met onbekende concentratie);
4) Magnetische roerder (gebruikt om de in de erlenmeyer aanwezige oplossing te roeren);
Niet stoppen nu... Er is meer na de reclame ;)
5) Buret (ontvangt de oplossing met bekende concentratie).
Een volume van de oplossing van onbekende concentratie met de fenolftaleïne-indicator wordt toegevoegd aan de erlenmeyer (onmiddellijk wordt de oplossing roze). In de buret wordt een bepaald volume van de oplossing met bekende concentratie geplaatst. Vervolgens wordt de zure oplossing uit de buret direct in de basische oplossing in de erlenmeyer gedruppeld. Dit druppelen duurt totdat de basisoplossing kleurloos wordt, op welk punt we het keerpunt noemen, wat aangeeft dat alle base in de oplossing volledig heeft gereageerd met het zuur.
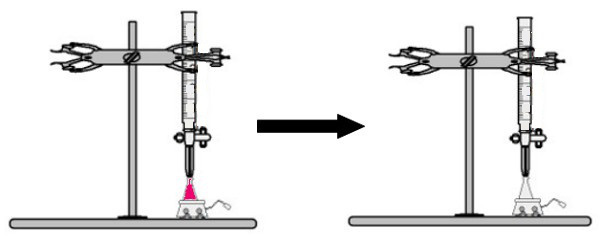
Op het keerpunt is de oplossing niet meer roze en kleurloos
Observatie: Als de oplossing met onbekende concentratie zuur is, zal deze kleurloos zijn wanneer deze de fenolftaleïne-indicator ontvangt. Het keerpunt in de titratie zal dus zijn wanneer de zure oplossing roze wordt bij ontvangst van de basische oplossing uit de buret.
Tot slot, om de concentratie van de basisoplossing te bepalen, gebruikt u gewoon de volgende vergelijking:
Ma.Va = Mb.Vb
Ma = zure molariteit;
Va = zuurvolume;
Mb = basismolariteit;
Vb = basisvolume.
Volg nu een voorbeeld van hoe de berekening van een oplossing met onbekende molariteit wordt uitgevoerd.
1e) 30 ml van een onbekende basisoplossing werd toegevoegd aan een Erlenmeyer-kolf om een titratie uit te voeren om de concentratie (molariteit) ervan te bepalen. Aan de buret werd 50 ml van een zure oplossing met een concentratie van 0,2 mol/L toegevoegd. Na druppelen van de zure oplossing en totdat de basische oplossing was getitreerd, werd waargenomen dat 20 ml van de zure oplossing bij de titratie werd gebruikt. Bepaal de molariteit van de gebruikte basisoplossing.
Oefening gegevens:
Vb = 30 ml
Mb = ?
Ma = 0,2 mol/L
Va = 20 ml
Aangezien de molariteit van het zuur en het volume respectievelijk 0,2 mol/L en 20 ml zijn, en het volume van de gebruikte base 30 ml is, gebruikt u gewoon de titratieformule:
Ma.Va = Mb.Vb
0.2.20 = Mb.30
4 = Mb.30
4 = Mb
30
Mb = 0,133 mol/L
Door mij Diogo Lopes Dias
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
DAGEN, Diogo Lopes. "Volometrische analyse of volumetrie"; Braziliaanse School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/analise-volumetrica.htm. Betreden op 28 juni 2021.