Hoe hoger de temperatuur, hoe groter de snelheid van een reactie.
Dit is gemakkelijk te zien in veel situaties in ons dagelijks leven, zoals in de volgende voorbeelden:
- Als we de ontbindingsreactie van een voedingsmiddel willen vertragen, verlagen we de temperatuur door het in de koelkast te plaatsen;

- Als we de kookreactie van het voedsel willen versnellen, doe het dan gewoon in een kookpot. druk die, met toenemende druk, ook de kooktemperatuur van het vloeibare water verhoogt waarin de eten is;

- Branden zijn over het algemeen verwoestend omdat de temperatuur van de omgeving stijgt, wat een toename van de snelheid van de verbrandingsreactie veroorzaakt;
- Om metabolische chemische processen te vertragen, waardoor de kans op hersenbeschadiging door zuurstoftekort, worden sommige operaties uitgevoerd door de lichaamstemperatuur van de patiënt te verlagen, zodat deze rond de 15°C;
- Als we een bruistablet in een glas heet water doen en een andere in een glas koud water, zal de eerste veel sneller oplossen.
Maar wat verklaart de direct proportionele invloed van temperatuur op de reactiesnelheid?
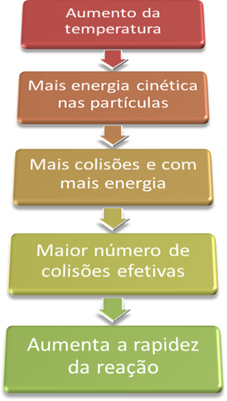
Dit komt omdat, zoals uitgelegd in de tekst “Voorwaarden voor het optreden van chemische reacties”, om een reactie te laten verlopen, moet aan een aantal voorwaarden worden voldaan, zoals dat de deeltjes ze moeten effectief botsen en met de minimaal benodigde energie, die activeringsenergie wordt genoemd.
Dus wanneer we de temperatuur van het systeem verhogen, verhogen we ook de agitatie van de reagerende deeltjes en geven we ze meer kinetische energie. Hierdoor zullen er meer botsingen plaatsvinden en met meer energie, waardoor de hoeveelheid deeltjes die zal reageren toeneemt en dus ook de reactiesnelheid.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/temperatura-velocidade-das-reacoes.htm