Zoals vermeld in de tekst "Reactievergelijking”, om chemische reacties weer te geven en de manier waarop ze worden verwerkt, hun kwantitatieve en kwalitatieve aspecten te begrijpen, werd overeengekomen om chemische vergelijkingen te gebruiken. Chemische vergelijkingen bevatten symbolen en getallen die aangeven welke stoffen aanwezig zijn en de juiste verhoudingen waarin ze reageren.
Door de interpretatie van deze vergelijkingen is het mogelijk om belangrijke gegevens te vinden die ons helpen om stoichiometrische berekeningen uit te voeren. De eerste stap zegt echter dat de vergelijking in evenwicht moet zijn, dat wil zeggen dat het totale aantal atomen van de reactanten gelijk moet zijn aan dat van de producten. Hoe u dit balanceren kunt uitvoeren, kunt u begrijpen via de tekst "Vergelijking balanceren”.
Begrijp echter eerst enkele belangrijke concepten in dit geval, zoals de betekenis van de termen: index, stoichiometrische coëfficiënt en mol. Deze termen zullen hieronder worden uitgelegd en geven ons een beter beeld van het kwantitatieve deel van de reactie:
- Inhoudsopgave: is het getal dat het aantal atomen van elk element in chemische formules aangeeft. Dit nummer komt rechts van het betreffende element en verschijnt subscript, dat wil zeggen in een kleinere lettergrootte.
Voorbeeld:
H2O (chemische formule van watersubstantie)
Wat betekent het:
- De elementen waaruit deze stof bestaat zijn H (waterstof) en O (zuurstof).
- De index van elk element geeft aan hoeveel atomen van elk aanwezig zijn in de formule van het watermolecuul:
H2O→ O-index: er is maar 1 zuurstofatoom.
↓
H-index: geeft aan dat er 2 waterstofatomen zijn.
Merk op dat in het geval van zuurstof er geen geschreven getal is, wat betekent dat er maar 1 atoom van dat element is, zoals hierboven uitgelegd.
Nu zijn er enkele gevallen waarin haakjes in formules voorkomen. Hoe moeten we dit interpreteren? Zie onderstaand voorbeeld:
Hier3(STOF4)2(chemische formule van calciumfosfaatsubstantie)
- Het Ca-gehalte geeft aan dat er 3 atomen van het element calcium aanwezig zijn in de chemische formule;
- De P (fosfor) en O (zuurstof) staan tussen haakjes, dus de index die buiten staat, in dit geval 2, hoort bij beide. Dus om erachter te komen hoeveel atomen van elk er in de formule zitten, moet je hun indices afzonderlijk vermenigvuldigen met de buitenste index. Let op hoe dit wordt gedaan:

Niet stoppen nu... Er is meer na de reclame ;)
P → index 1 O → index 4
P = 1. 2O = 4. 2
P = 2 O = 8
Er zijn dus 2 fosfor- en 8 zuurstofatomen.
- Stoichiometrische coëfficiënt: is het getal dat vóór de formule staat om de hoeveelheid van elke stof en het aandeel moleculen dat aan de reactie deelneemt aan te geven. Dus, zoals in het geval van de index, wanneer de coëfficiënt gelijk is aan 1, is het niet nodig om het op te schrijven, zoals het wordt geïmpliceerd.
Voorbeeld:
2H2 + 1O2 → 2 H2O (deze watervormingsreactie wordt getoond in de inleidende figuur)
↓ ↓ ↓
Reactiecoëfficiënten
In deze vergelijking wordt door de coëfficiënten aangetoond dat twee moleculen waterstofgas reageren met één van zuurstofgas, om twee moleculen water als een product te vormen. De stoichiometrische verhouding van deze reactie is dus 2:1:2.
Om het totale aantal atomen van elk element dat in de reactie aanwezig is te weten te komen, is het noodzakelijk om de coëfficiënten te vermenigvuldigen met de indices van elk element:
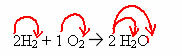
reagentia:
H = 2. 2 = 4 waterstofatomen
O = 1. 2 = 2 zuurstofatomen
Product:
H = 2. 2 = 4 waterstofatomen
O = 1. 2 = 2 zuurstofatomen
Merk op dat je dezelfde hoeveelheid hebt gegeven aan de reactanten en de producten, wat betekent dat de reactie correct is uitgebalanceerd.
- Mol (hoeveelheid stof):in een chemische vergelijking worden de coëfficiënten geacht de hoeveelheid mol of de hoeveelheid materie aan te geven. Dus in het vorige geval hebben we 2 mol H2 reageren met 1 mol O2, genererend als producten 2 mol H2O.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijk:
FOGAÇA, Jennifer Rocha Vargas. "Kwantitatieve termen in een chemische vergelijking"; Braziliaanse School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/termos-quantitativos-uma-equacao-quimica.htm. Betreden op 27 juli 2021.