Oxidatie is de naam die wordt gegeven aan het proces van verlies van elektronen door een atoom, groep of ionensoort tijdens a chemische reactie. Het wordt geïdentificeerd door de toename van NOX (oxidatiegetal) van de soort of het atoom bij het vergelijken van reactant en product.
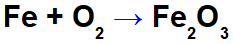
IJzer oxidatie vergelijking.
In de bovenstaande vergelijking kunnen we bijvoorbeeld de NOX van elk van de deelnemers aangeven:
Reagensijzer (Fe): heeft NOX 0 omdat het a. is eenvoudige substantie;
Zuurstof in reagens (O): heeft NOX 0 omdat het een eenvoudige stof is;
Zuurstof in het product: het heeft NOX -2 omdat het niet gebonden is aan een alkalimetaal, Alkalische aarde of waterstofvorming peroxiden of superoxiden;
IJzer in het product: het heeft NOX +3 omdat de som van de NOX van ijzer vermenigvuldigd met 2 (aantal atomen) + NOX van zuurstof vermenigvuldigd met 3 moet resulteren in 0 omdat het een samengestelde stof is:
x.2 + 3.(-2) = 0
2x - 6 = 0
2x = +6
x = + 6
2
x = +3
Door de NOX van het reagensijzer (0) te vergelijken met het product (+3), zagen we een toename, dat wil zeggen, het onderging het proces van
oxidatie. Het is vermeldenswaard dat het optreden van oxidatie het gaat altijd gepaard met het fenomeen van reductie (wat de winst van elektronen betekent), geïdentificeerd door de afname van NOx, zoals in het voorbeeld gebeurt met zuurstof.Lees ook:Bepaling van het oxidatiegetal (NOX)
Voorbeelden van situaties waarin oxidatie optreedt:
1. Verbranding

De verbranding van een materiaal is ook indicatief voor oxidatie.
Verbranding is elke chemische reactie die optreedt in aanwezigheid van a brandstof elk en het oxiderende zuurstofgas (O2), wat resulteert in de productie van warmte en licht. Bij elke verbrandingsreactie treedt oxidatie.
2. Enkele organische reacties
In elke organische reactie die plaatsvindt in aanwezigheid van de onderstaande middelen, is het proces van oxidatie:
Kaliumdichromaat (K2Cr2O7) of kaliumpermanganaat (KMnO4);
Aanwezigheid van sterk zuur of sterke base;
Ozongas (O3) in aanwezigheid van metallisch zink (Zn) en water (H2O).
3. Batterijen of batterijen

Batterijen zijn apparaten waarin altijd oxidatie optreedt.
Stapels of batterijen zijn elektrochemische apparaten die chemische stoffen opslaan. Een van deze stoffen zal oxidatie ondergaan, en de andere zal reductie ondergaan, wat resulteert in de productie van elektrische stroom.
4. elektrolyse
elektrolyse is een chemisch proces waarbij een waterige oplossing die een zout bevat, wordt onderworpen aan een elektrische stroom, wat uiteindelijk de oxidatie van anionen in deze materialen bevordert. Bij alle elektrolyse is er: oxidatie.
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-oxidacao.htm

