DE oplosbaarheidkan worden gedefinieerd als de maximaal mogelijke hoeveelheid van een opgeloste stof die bij een bepaalde temperatuur in een bepaalde hoeveelheid oplosmiddel kan worden opgelost.
Deze maximale hoeveelheid die kan worden opgelost, wordt ook wel genoemd: oplosbaarheidscoëfficiënt of oplosbaarheidsgraad. Maar de oplosbaarheid van een stof hangt onder andere af van het type oplosmiddel waarin de opgeloste stof is gedispergeerd.
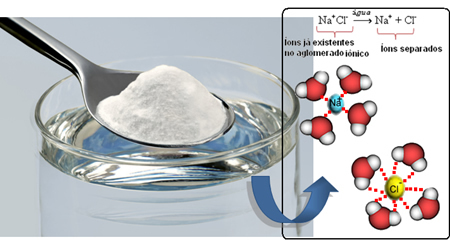
NaCl (natriumchloride - keukenzout) is bijvoorbeeld zeer goed oplosbaar in water en in 1 L water van 20ºC kunnen we tot 360 gram van dit zout oplossen. Maar wanneer het oplosmiddel in benzine verandert, onder dezelfde omstandigheden van volume, temperatuur en druk, lost het zout niet op.
Waarom verschilt de oplosbaarheid van een stof zo sterk van oplosmiddel tot oplosmiddel?
Een van de factoren is de polariteit van de betrokken verbindingen. In het aangehaalde voorbeeld hebben we dat de zout is polair, water is polair en benzine is niet-polair. Zout wordt gevormd door atomen van natrium (Na) en chloor (Cl) die zich binden door middel van ionische bindingen, waarbij natrium beslist een elektron aan chloor doneert, waardoor Na-ionen worden gevormd
+ en Cl-. Omdat deze ionen tegengestelde ladingen hebben, trekken ze elkaar aan en houden ze elkaar vast (Na+kl-).
Dit laat ons zien dat zout echt polair is, elke ionbinding is polair, omdat er een verschil is in elektrische lading in de verbinding.
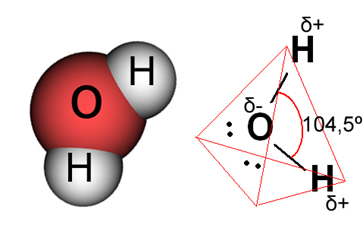
In het geval van water is de bestaande binding covalent, waarbij twee waterstofatomen elektronen delen met een zuurstofatoom. Het watermolecuul heeft twee dipolen, waarbij zuurstof een gedeeltelijk negatieve lading heeft en waterstof een gedeeltelijk positieve lading (δ- O ─ H δ+). Maar deze dipolen heffen elkaar niet op, omdat het watermolecuul elkaar onder een hoek van 104,5º ontmoet, wat aantoont dat de verdeling en lading langs het molecuul niet uniform is. Er is een grotere negatieve ladingsdichtheid op het zuurstofatoom van het molecuul. Dit laat ons zien dat het watermolecuul echt polair is.
Dus als we het zout in het water mengen, het positieve deel van het zout, dat zijn de Na-kationen.+, wordt aangetrokken door het negatieve deel van water, dat zuurstof is, en het negatieve deel van zout (Cl anionen-) wordt aangetrokken door het positieve deel van het water (H+). Bijgevolg heeft de vakbond Na+kl- het wordt gebroken, waardoor het zout in het water wordt opgelost.
Benzine daarentegen wordt gevormd door een mengsel van verschillende koolwaterstoffen, die niet-polair zijn, dat wil zeggen dat de verdeling van de elektrische lading van benzine uniform is. Er is dus geen interactie van de zoutionen met benzine en het lost niet op.
Deze en andere soortgelijke gevallen leiden ons tot de volgende conclusie:

Dit kan echter niet als een algemene regel worden beschouwd, aangezien er veel gevallen zijn van niet-polaire opgeloste stoffen die goed oplossen in polaire oplosmiddelen en vice versa. Dus om te begrijpen waarom dit gebeurt, moeten we nog een andere factor in overweging nemen: het type intermoleculaire kracht van het oplosmiddel en de opgeloste stof.
Wet hierover in de tekst: "Verband tussen intermoleculaire sterkte en oplosbaarheid van stoffen”.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/relacao-entre-polaridade-solubilidade-das-substancias.htm