Kps is het acroniem dat wordt gebruikt om de. weer te geven oplosbaarheid product constante, die verwijst naar het product (vermenigvuldiging) van de concentraties in hoeveelheid materie van de ionen die in een oplossing aanwezig zijn.
Telkens wanneer een slecht oplosbare opgeloste stof wordt toegevoegd aan een oplosmiddel zoals bariumsulfaat, wordt een kleine hoeveelheid een deel van dit zout lost op in het water en de rest hoopt zich op op de bodem van de container en vormt het lichaam van achtergrond. Het zout dat oplost, lijdt dissociatie, waardoor kationen en anionen in het water vrijkomen.

Neerslag aanwezig in een oplossing met water en bariumsulfaat
Bovendien is het zout niet goed? oplosbaarheid, verandert de hoeveelheid opgeloste opgeloste stof niet in de loop van de tijd omdat er een oplosevenwicht is tussen de zoutionen (aanwezig in de oplossing) en het achtergrondlichaam.

BaSO-oplossingsbalans4 in water
Kps van een opgeloste stof
O Kps van een opgeloste stof is het product van de molaire concentraties van de deelnemende ionen. Het is altijd nodig om de ionenconcentratie te verhogen tot de respectieve stoichiometrische coëfficiënt (gebruikt om de vergelijking in evenwicht te brengen).

Oplosevenwicht van elektrolyt YDeXB
O Kps van het voorgestelde evenwicht voor zout YDeXB het zal de concentratie van reagens Y hebben (verhoogd tot zijn stoichiometrische coëfficiënt (a) en de concentratie van product X (verhoogd tot zijn stoichiometrische coëfficiënt (b)).
Kps = [Y+b]De.[X-De]B
Voorbeeld
Stel dat we een oplossing bereiden met water en aluminiumcyanide [Al(CN)3], een praktisch onoplosbaar zout in water. Wanneer dit zout aan water wordt toegevoegd, krijgt het uiteindelijk het fenomeen van dissociatie.

Al (CN) elektrolytoplossingsevenwicht3
Dus, door de vergelijking van het evenwicht van zoutoplossing, hebben we dat zijn Kps zal de vermenigvuldiging van de concentratie van het aluminiumkation hebben (Al+3) verhoogd tot exponent 1 door de concentratie van cyanide-anion (CN-1) verhoogd tot exponent 3.
Kps = [Al+3]1.[CN-1]3
Kps betekenissen van een opgeloste stof
Wanneer we de vinden Kps van een bepaald zout gemengd met water, kennen we ook de concentratie van elk van de ionen in de oplossing. Met deze gegevens kunnen we de rangorde van een oplossing of het gedrag van de opgeloste stof in de oplossing bepalen. Denk aan de volgende balans:

Oplosevenwicht van elektrolyt YDeXB
We kunnen de volgende relaties maken:
Als Kps = [Y+b]De.[X-De]B = 0, we hebben een verzadigde oplossing zonder de aanwezigheid van neerslag;
Als Kps > [Y+b]De.[X-De]B = 0, we hebben een onverzadigde oplossing, dat wil zeggen een kleine hoeveelheid opgeloste stof opgelost in het oplosmiddel (in verhouding tot oplosbaarheidscoëfficiënt);
Als Kps < [Y+b]De.[X-De]B = 0, we hebben een verzadigde oplossing met een bodemlichaam, dat wil zeggen dat er een precipitatie van de elektrolyt (opgeloste stof) zal zijn;
Als de Kps-waarde van het elektrolyt te laag is, is het een slecht oplosbaar materiaal in het oplosmiddel.
Voorbeeld van Kps-berekening van een opgeloste stof
(UERN): De oplosbaarheid van calciumnitraat [Ca (NO3)2] in water is 2,0. 10–3 mol/liter bij een bepaalde temperatuur. De Kps van dit zout bij dezelfde temperatuur is:
a) 8.10–8.
b) 8.10–10.
c) 3.2.10–10
d) 3.2.10–8
Oefening gegevens:
Formule van zout: Ca (NO3)2;
Molaire zoutconcentratie (oplosbaarheid): 2,0. 10–3 mol/L.
Om Kps op te lossen en te berekenen, moet u het volgende doen:
Stap 1: Stel de zoutoplossingsbalans in.
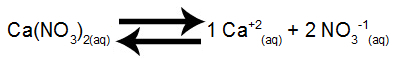
Calciumnitraatoplossingsevenwicht in water
Calciumnitraat geeft bij dissociatie in water 1 mol calciumkationen vrij (Ca+2) en 2 mol nitraatanionen (NO3-1).
Stap 2: Stel de uitdrukking van de Kps van het zout samen
De Kps van dit zout is het product van de calciumkationconcentratie verhoogd tot exponent 1 door de concentratie van het nitraatanion verhoogd tot exponent 2, zoals hieronder weergegeven:
Kps = [Ca+2]1.[BIJ DE3-1]2
Stap 3: Bepaal de waarden van ionenconcentraties in de oplossing
Om de Kps te berekenen, hebben we de waarden van de ionenconcentraties nodig, maar de oefening leverde de molariteit van het zout in de oplossing op. Om de concentratie van elk ion te bepalen, vermenigvuldigt u eenvoudig de molariteit van het zout met de stoichiometrische coëfficiënt van de deelnemer aan de reactie:
Voor calciumkation:
[Hier+2] = 1. 2,0. 10–3
[Hier+2] = 2,0. 10–3 mol/L
Voor het nitraatanion:
[BIJ DE3-1] = 2. 2,0. 10–3
[BIJ DE3-1] = 4,0. 10–3 mol/L
Stap 4: Gebruik de concentratiewaarden gevonden in stap 3 in de Kps-uitdrukking (bepaald in stap 2).
Kps = [Ca+2]1.[BIJ DE3-1]2
Kps = [2.10-3]1.[4.10-3]2
Kps = 2.10-3.16.10-6
Kps = 32.10-9
of
Kps = 3.2.10-9 (ma/l)
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kps.htm
