Organische chemie is een breed gebied van chemie dat koolstofverbindingen bestudeert.
De kennis van Organische Chemie wordt op verschillende manieren benaderd en, er over nadenkend, hebben we voorgestelde oefeningen, toelatingsexamens en Enem-vragen voor je samengesteld om je kennis te testen.
Gebruik ook de opmerkingen over resoluties om nog meer over het onderwerp te weten te komen.
Voorgestelde oefeningen
vraag 1
Bekijk de onderstaande organische verbindingen en identificeer de organische functies volgens de gemarkeerde functionele groepen. Benoem daarna de stoffen.
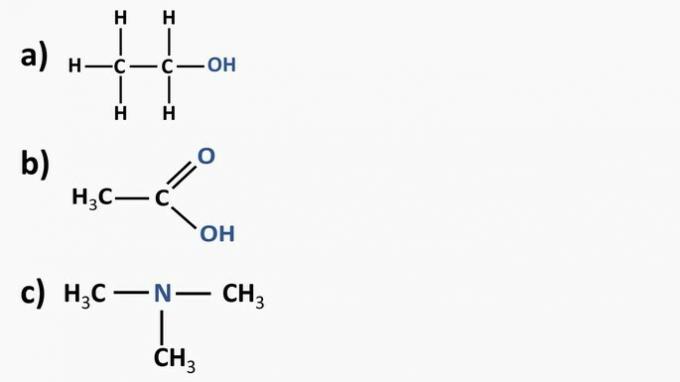
Antwoord:
a) Organische verbinding: ethanol
- organische functie: alcohol
- Algemene formule: R-OH
- Identificatie: hydroxyl (OH) gekoppeld aan de koolstofketen
b) Organische verbinding: ethaanzuur.
- Organische functie: carbonzuur
- Algemene formule: R-COOH
- Identificatie: carboxylradicaal (COOH) gekoppeld aan de koolstofketen
c) Organische verbinding: trimethylamine
- Organische functie: amine (tertiair)
- Algemene formule:
- Identificatie: stikstof gekoppeld aan drie koolstofketens
vraag 2
In de organische chemie worden verbindingen herkend aan de ketens gevormd door koolstof en waterstof. Er kunnen echter ook andere elementen deel uitmaken van de chemische structuur van deze verbindingen, zoals zuurstof.
Selecteer het alternatief waarbij de twee organische verbindingen zuurstofrijke organische functies hebben.
a) chloroform en ethylmethaan
b) propanol en propaanzuur
c) etheen en ethaandiol
d) ethaanamide en benzeen
Correct antwoord: b) propanol en propaanzuur
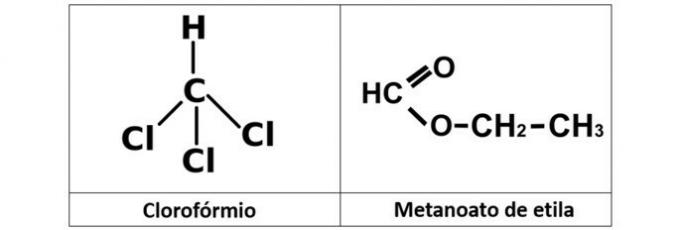
een fout. We hebben chloroform (CHCl3), dat een alkylhalogenide is, en de ethylmethanoaatester (C3H6O2), die zuurstof in zijn structuur bevat.
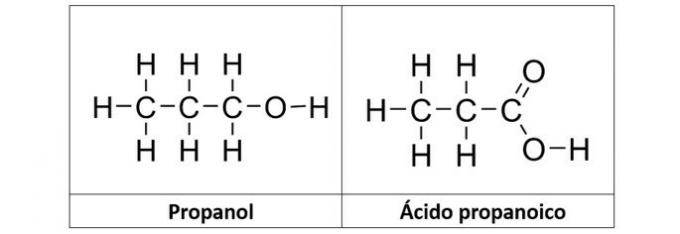
b) JUIST. In dit alternatief hebben we twee verbindingen die geoxygeneerde organische functies hebben. De propanol (C3H8O) is een alcohol gevormd door drie koolstoffen. Het propaanzuur (C3H6O2) is een carbonzuur.
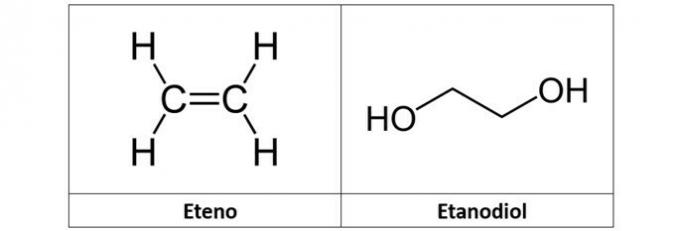
c) FOUT. Het ethyleen (C2H4), ook wel ethyleen genoemd, is een koolwaterstof van het alkeentype. Reeds ethaandiol (C2H6O2) is een alcohol met twee hydroxylen in zijn structuur.
d) FOUT. Ethaanamide (C2H5NO) is een amide en benzeen is een aromatische koolwaterstof en wordt daarom alleen gevormd door koolstof en waterstof.

vraag 3
Kijk naar de structuur van de organische verbinding hieronder en controleer de ware uitspraken.

(01) De verbinding heeft een organische stikstoffunctie.
(02) Het is een primair amine, omdat het aan slechts één waterstof is gebonden.
(03) De naam van de verbinding is diethylamine.
Correct antwoord:
(01) JUIST. De organische stikstoffunctie die in de verbinding aanwezig is, is amine.
(02) FOUT. Het is een secundair amine, omdat stikstof is gekoppeld aan twee koolstofketens.
(03) FOUT. De naam van de verbinding is dimethylamine, omdat er twee methylradicalen aan stikstof zijn bevestigd.
vraag 4
Eugenol, een lid van de familie van fenylpropanoïden, is een aromatische organische verbinding die aanwezig is in kruidnagel, een specerij die al sinds de oudheid wordt gebruikt.

Let op de structuurformule van de verbinding en identificeer de aanwezige organische functies.
a) Alcohol en ether
b) Fenol en ether
c) Alcohol en ester
d) Fenol en ester
e) Alcohol en koolwaterstof
Correct alternatief: b) Fenol en ether.
Eugenol heeft geoxygeneerde organische functies in zijn keten, dat wil zeggen, naast koolstof- en waterstofatomen, is zuurstof een aanwezig heteroatoom.
De organische functie van fenol wordt gekenmerkt door de hydroxyl (-OH) bevestigd aan een aromatische ring. In de etherfunctie bevindt zuurstof zich tussen twee koolstofketens.
vraag 5
EDTA, voluit ethyleendiaminetetraazijnzuur, is een organische verbinding met vele toepassingen. Het vermogen om metaalionen te binden maakt het een chelaatvormer die veel wordt gebruikt, zowel in het laboratorium als industrieel.
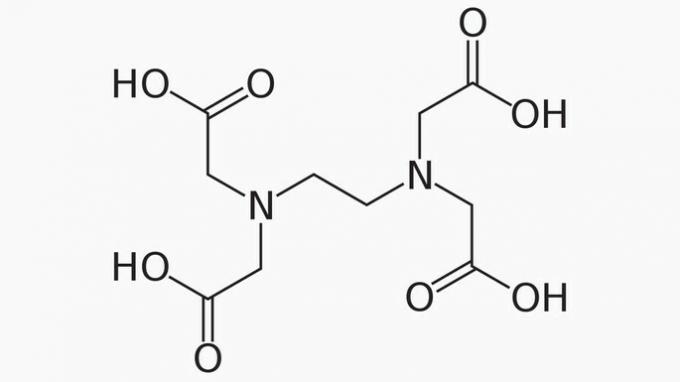
Over EDTA is het correct om te stellen dat de koolstofketen:
a) Open, homogeen en onverzadigd.
b) Gesloten, heterogeen en verzadigd.
c) Open, heterogeen en onverzadigd.
d) Gesloten, homogeen en verzadigd.
e) Open, heterogeen en verzadigd.
Correct antwoord: e) Open, heterogeen en verzadigd.
De EDTA-keten is onderverdeeld in:
OPEN. Volgens de rangschikking van de koolstofatomen in de structuur van EDTA, merkten we dat, door de aanwezigheid van uiteinden, de keten van de verbinding wordt geopend.
HETEROGEEN. Naast koolstof- en waterstofverbindingen heeft de koolstofketen stikstof- en zuurstofheteroatomen.
VERZADIGD. De bindingen tussen de koolstofatomen zijn verzadigd, omdat de keten slechts enkele bindingen heeft.
Meer informatie op: Organische chemie.
toelatingsexamen vragen
vraag 1
(UFSC) Observeer de onvolledige organische structuren en identificeer de juiste item(s):
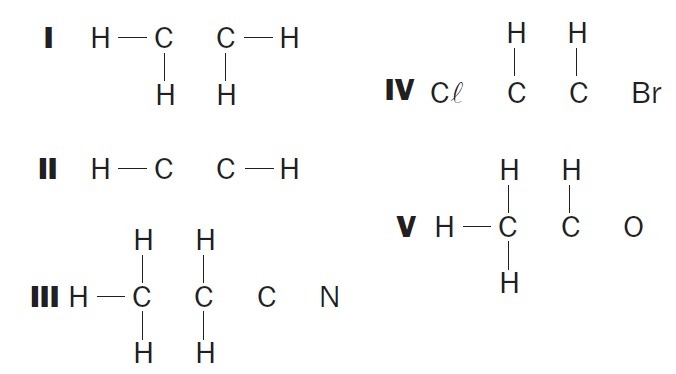
(01) Structuur I mist een enkele binding tussen de koolstofatomen.
(02) Structuur II mist een drievoudige binding tussen de koolstofatomen.
(03) Structuur III mist twee enkelvoudige bindingen tussen koolstofatomen en een triple tussen koolstof- en stikstofatomen.
(04) Structuur IV mist twee enkele bindingen tussen koolstofatomen en halogenen en een dubbele binding tussen koolstofatomen.
(05) Structuur V mist een enkele binding tussen koolstofatomen en een enkele binding tussen koolstof- en zuurstofatomen.
Correcte alternatieven: 02, 03 en 04.
Naast koolstof, een verplicht chemisch element in organische verbindingen, kunnen andere elementen aanwezig zijn in structuren en gebonden zijn door covalente bindingen, waarbij elektronen worden gedeeld.
De valentie van de elementen bepaalt het aantal bindingen dat kan worden gevormd, zoals weergegeven in de onderstaande tabel.
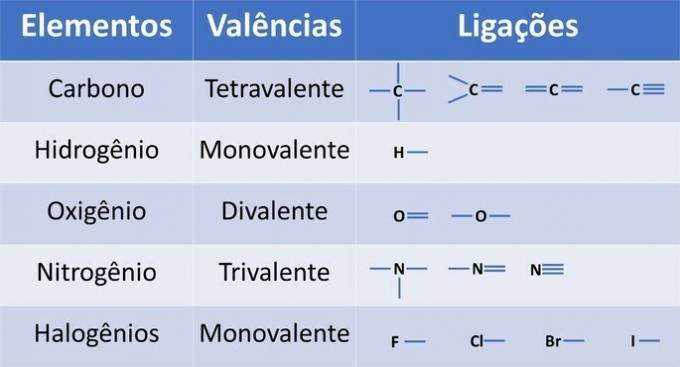
Van deze informatie hebben we:
(01) FOUT. De structuur mist een dubbele binding tussen de koolstofatomen om de etheenverbinding te vormen.
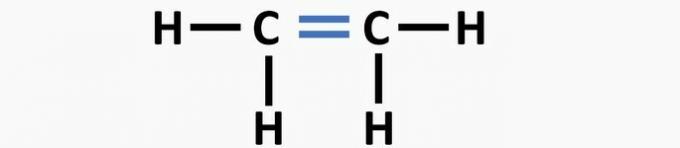
(02) JUIST. De structuur mist een drievoudige binding tussen de koolstofatomen om de ethynverbinding te vormen.
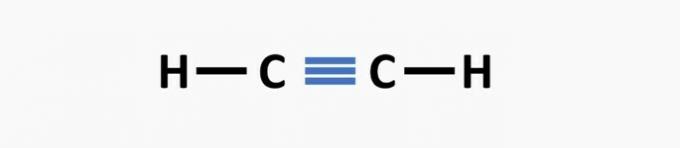
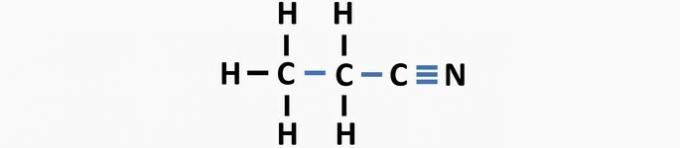
(03) JUIST. De structuur mist enkele bindingen tussen koolstofatomen en drievoudige bindingen tussen koolstof en stikstof om de verbinding propaannitril te vormen.
(04) JUIST. De structuur mist enkele bindingen tussen koolstof en halogeen en dubbele bindingen tussen koolstoffen om de dichlooretheenverbinding te vormen.
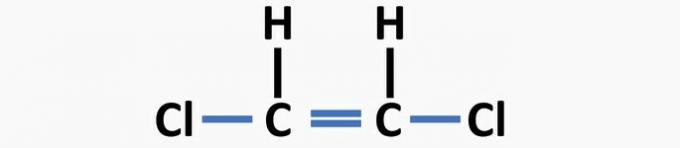
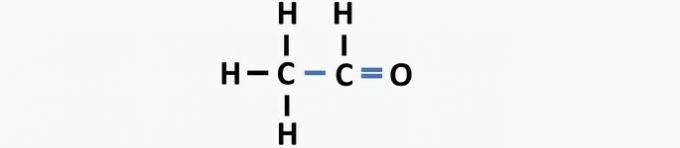
(05) FOUT. De structuur mist een enkele binding tussen koolstoffen en een dubbele binding tussen koolstof en zuurstof om de ethanalverbinding te vormen.
vraag 2
(UFPB) De structuur van de organische verbinding met molecuulformule C5H8Wat presenteert een vertakte, onverzadigde, heterogene en alicyclische keten is:

Correct alternatief: d.
Koolstofketens kunnen als volgt worden ingedeeld:
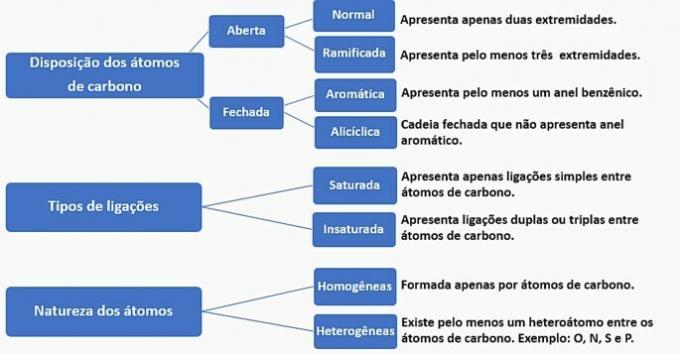
Volgens deze informatie hebben we:
een fout. De keten is geclassificeerd als normaal, verzadigd, homogeen en alicyclisch.
b) FOUT. De keten is geclassificeerd als normaal, onverzadigd, homogeen en open.
c) FOUT. De keten is geclassificeerd als vertakt, onverzadigd, homogeen en open.
d) JUIST. De keten is geclassificeerd als vertakt, onverzadigd, heterogeen en alicyclisch, zoals
- Het heeft een vertakking: methylradicaal;
- Heeft onverzadiging: dubbele binding tussen koolstofatomen;
- Het heeft een heteroatoom: zuurstof gebonden aan twee koolstofatomen;
- Het presenteert een gesloten keten: koolstoffen die in een cirkel zijn verbonden zonder de aanwezigheid van een aromatische ring.
e) FOUT. De keten is geclassificeerd als vertakt, onverzadigd, heterogeen en open.
vraag 3
(Centec-BA) In de onderstaande structuur zijn de genummerde koolstoffen respectievelijk:
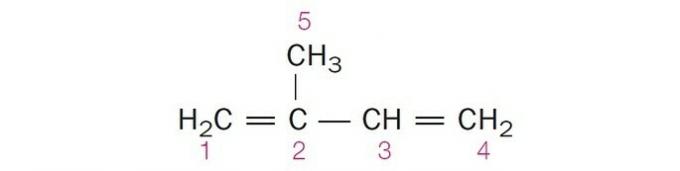
a) sp2, sp, sp2, sp2, sp3.
b) sp, sp3, sp2, sp, sp4.
c) sp2, sp2, sp2, sp2, sp3.
d) sp2, sp, sp, sp2, sp3.
e) sp3, sp, sp2, sp3, sp4.
Correct alternatief: c) sp2, sp2, sp2, sp2, sp3.
Omdat het 4 elektronen in de valentieschil heeft, is koolstof vierwaardig, dat wil zeggen dat het de neiging heeft om 4 covalente bindingen te vormen. Deze bindingen kunnen enkelvoudig, dubbel of drievoudig zijn.
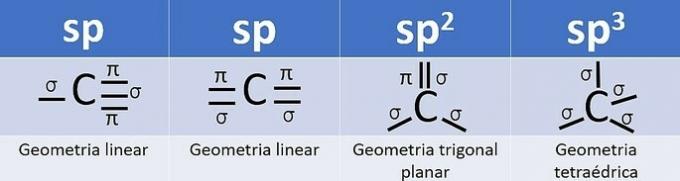
Het aantal hybride orbitalen is de som van de sigmabindingen (σ) van de koolstof, aangezien de binding hybridiseert niet.
- sp: 2 sigma-links
- sp2: 3 sigma-links
- sp3: 4 sigma-links
Volgens deze informatie hebben we:
een fout. Koolstof 2 heeft sp-hybridisatie2, want het heeft 3 σ obligaties en één obligatie .
b) FOUT. Koolstof heeft geen sp-hybridisatie4 en sp-hybridisatie vindt plaats wanneer er een drievoudige binding of twee dubbele bindingen tussen koolstoffen is.
c) JUIST. De som van de σ-bindingen op elke koolstof geeft de alternatieve hybridisatie.
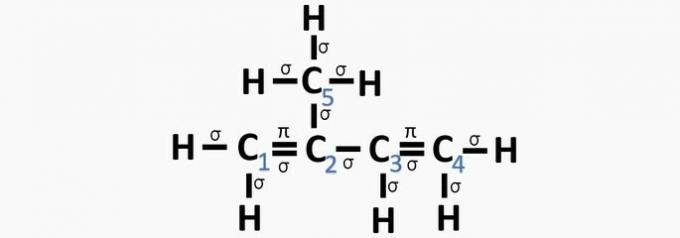
d) FOUT. Sp-hybridisatie vindt plaats wanneer er een drievoudige binding of twee dubbele bindingen tussen koolstoffen is.
e) FOUT. Koolstof heeft geen sp-hybridisatie4 en sp-hybridisatie vindt plaats wanneer er een drievoudige binding of twee dubbele bindingen tussen koolstoffen is.
vraag 4
(UFF) Er is een gasvormig monster gevormd door een van de volgende verbindingen: CH4; Ç2H4; Ç2H6; Ç3H6 of C3H8. Als 22 g van dit monster een volume van 24,6 L inneemt bij een druk van 0,5 atm en een temperatuur van 27 °C (Gegeven: R = 0,082 L .atm. K–1.mol–1), wordt geconcludeerd dat het het gas is:
a) ethaan.
b) methaan.
c) propaan.
d) propyleen.
e) etheen.
Correct alternatief: c) propaan.
1e stap: zet de temperatuureenheid om van Celsius naar Kelvin.
2e stap: bereken het aantal mol van de verbinding met behulp van de algemene gasvergelijking.
3e stap: bereken de molaire massa van de verbinding.
4e stap: zoek de koolwaterstof met een molecuulmassa van 44 g/mol.
methaan
Etheen
ethaan
propyleen
Propaan
Er wordt dus geconcludeerd dat het gas dat overeenkomt met de informatie in de verklaring propaan is.
vraag 5
(ITA) Denk aan de volgende stoffen:
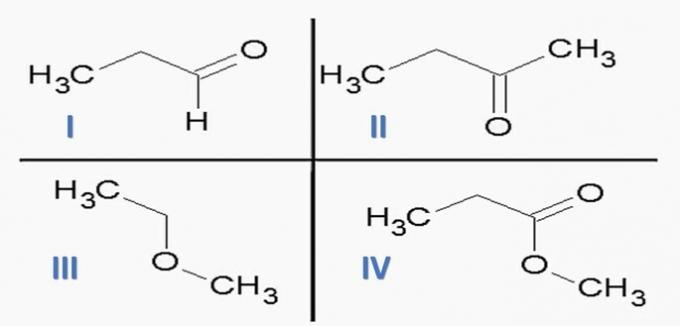
en de volgende chemische functies:
De. carbonzuur;
B. alcohol;
ç. aldehyd;
d. keton;
en. ester;
f. ether.
De optie die stoffen CORRECT associeert met chemische functies is:
a) identiteitsbewijs; IIc; IIIe; IVf.
b) Ic; IId; IIIe; VAT
c) Ic; IId; IIIf; IVe.
deed; IIc; IIIf; IVe.
e) Ia; IIc; IIIe; IVd.
Correct alternatief: c) Ic; IId; IIIf; IVe.
Organische functies worden bepaald door structuren en groeperen organische verbindingen met vergelijkbare kenmerken.
De chemische functies die aanwezig zijn in de alternatieven zijn:
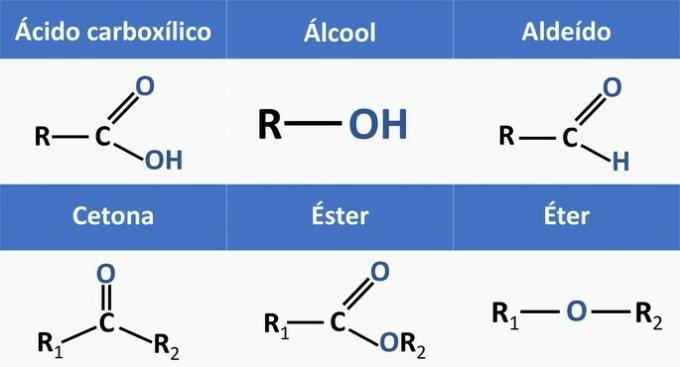
Als we de bovenstaande structuren en de verbindingen in de verklaring analyseren, hebben we:
een fout. De orgelfuncties zijn correct, maar de volgorde is verkeerd.
b) FOUT. Er is geen carbonzuur tussen de verbindingen.
c) JUIST. Functionele groepen die aanwezig zijn in de verbindingen vertegenwoordigen de volgende chemische functies.

d) FOUT. I is aldehyde en II is keton.
e) FOUT. Er is geen carbonzuur tussen de verbindingen.
Meer informatie op: Organische functies.
vijandelijke vragen
vraag 1
(Enem/2014) Een methode voor het bepalen van het ethanolgehalte in benzine bestaat uit het mengen van bekende hoeveelheden water en benzine in een specifieke fles. Nadat de kolf is geschud en enige tijd is gewacht, worden de volumes van de twee verkregen niet-mengbare fasen gemeten: de ene organische en de andere waterige. Ethanol, ooit mengbaar met benzine, is nu mengbaar met water.
Om het gedrag van ethanol voor en na het toevoegen van water te verklaren, is het noodzakelijk om te weten:
a) de dichtheid van vloeistoffen.
b) de grootte van de moleculen.
c) het kookpunt van vloeistoffen.
d) de atomen die in de moleculen aanwezig zijn.
e) het type interactie tussen de moleculen.
Correct alternatief: e) het type interactie tussen de moleculen.
Intermoleculaire krachten beïnvloeden de oplosbaarheid van organische verbindingen. Stoffen hebben de neiging om met elkaar op te lossen als ze dezelfde intermoleculaire kracht hebben.
Zie in onderstaande tabel enkele voorbeelden van organische functies en het soort interactie tussen moleculen.
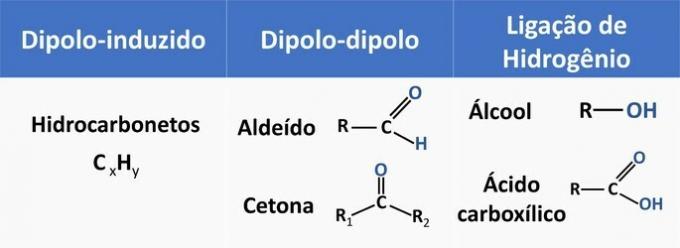
Ethanol wordt beschouwd als een polair oplosmiddel, omdat het een polaire groep (-OH) in zijn structuur heeft. De koolstofketen ervan, die niet-polair (CH) is, kan echter een interactie aangaan met niet-polaire oplosmiddelen. Daarom lost ethanol zowel in water als in benzine op.
Volgens deze informatie hebben we:
een fout. Dichtheid relateert de massa van een lichaam aan het bezette volume.
b) FOUT. De grootte van de moleculen beïnvloedt de polariteit van de verbindingen: hoe groter de koolstofketen, hoe meer apolair de stof wordt.
c) FOUT. Het kookpunt is handig voor het scheiden van moleculen: destillatie scheidt verbindingen met verschillende kookpunten. Hoe lager het kookpunt, hoe gemakkelijker het molecuul verdampt.
d) FOUT. Een aldehyde heeft koolstof, waterstof en zuurstof in zijn structuur. Deze verbinding voert dipool-dipool-interacties uit, terwijl een alcohol, met dezelfde elementen, in staat is waterstofbruggen te vormen.
e) JUIST. De interactie van ethanol met water (waterstofbinding) is intenser dan met benzine (diplo-geïnduceerd).
vraag 2
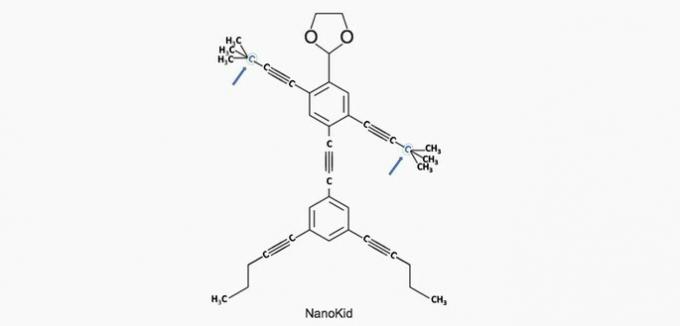
(Enem/2013) De moleculen van nanoputianen ze lijken op menselijke figuren en zijn gemaakt om de interesse van jonge mensen te wekken om de taal te begrijpen die wordt uitgedrukt in structuurformules, die veel worden gebruikt in de organische chemie. Een voorbeeld is NanoKid, weergegeven in de figuur:
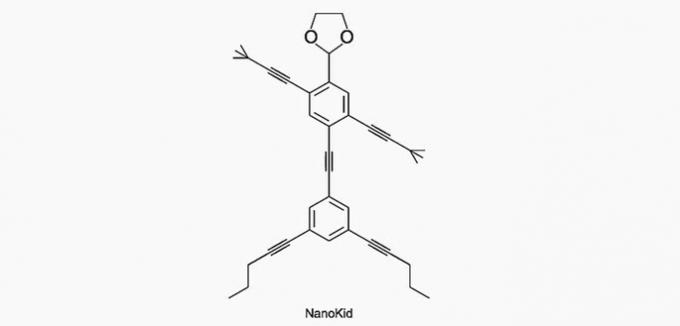
Waar in het lichaam van de NanoKid bevindt zich quaternaire koolstof?
a) Handen.
b) Hoofd.
c) Borst.
d) Buik.
e) Voeten.
Correct alternatief: a) Handen.
Koolstof is als volgt ingedeeld:
- Primair: bindt aan een koolstof;
- Secundair: bindt aan twee koolstoffen;
- Tertiair: bindt aan drie koolstofatomen;
- Quaternair: bindt aan vier koolstoffen.
Zie de voorbeelden hieronder.

Volgens deze informatie hebben we:
a) JUIST. De koolstof in de hand is gebonden aan vier andere koolstoffen, dus het is quaternair.
b) FOUT. De kop is gemaakt van primaire koolstoffen.
c) FOUT. De kist bestaat uit secundaire en tertiaire koolstofatomen.
d) FOUT. De buik bestaat uit secundaire koolstoffen.
e) FOUT. De voeten zijn gemaakt van primaire koolstoffen.
vraag 3
(Enem/2014) Sommige polymere materialen kunnen niet worden gebruikt voor de productie van bepaalde soorten artefacten, ook niet voor beperkingen van mechanische eigenschappen, hetzij door het gemak waarmee ze worden aangetast, waardoor ongewenste bijproducten worden gegenereerd toepassing. Daarom wordt inspectie belangrijk om de aard van het polymeer te bepalen dat bij de vervaardiging van het artefact wordt gebruikt. Een van de mogelijke methoden is gebaseerd op de ontleding van het polymeer om de monomeren te genereren die het hebben veroorzaakt.
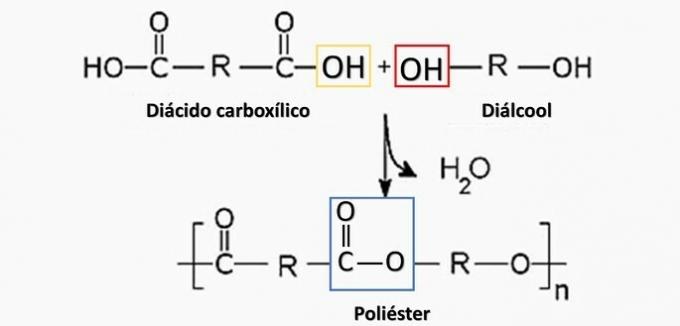
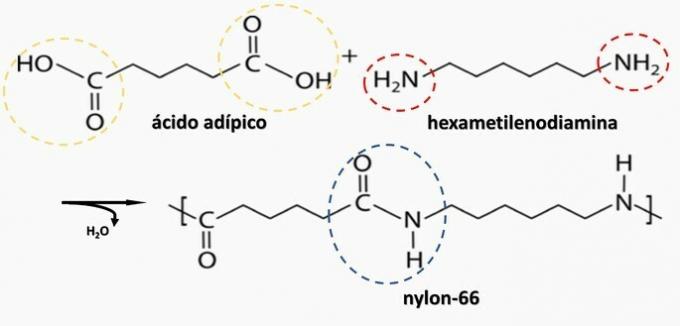
Gecontroleerde ontleding van een artefact gegenereerd diamine H2N(CH2)6NH2 en het HO dizuur2C(CH2)4CO2H. Daarom is het artefact gemaakt van:
a) polyester.
b) polyamide.
c) polyethyleen.
d) polyacrylaat.
e) polypropyleen.
Correct alternatief: b) polyamide.
een fout. Polyester wordt gevormd bij de reactie tussen een dicarbonzuur (-COOH) en een dialcohol (-OH).
b) JUIST. Polyamide wordt gevormd door de polymerisatie van een dicarbonzuur (-COOH) met een diamine (-NH2).
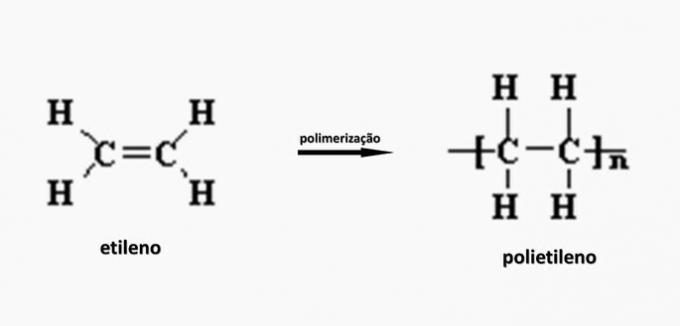
c) FOUT. Polyethyleen wordt gevormd bij de polymerisatie van ethyleenmonomeer.
d) FOUT. Polyacrylaat wordt gevormd door een zout afgeleid van carbonzuur.
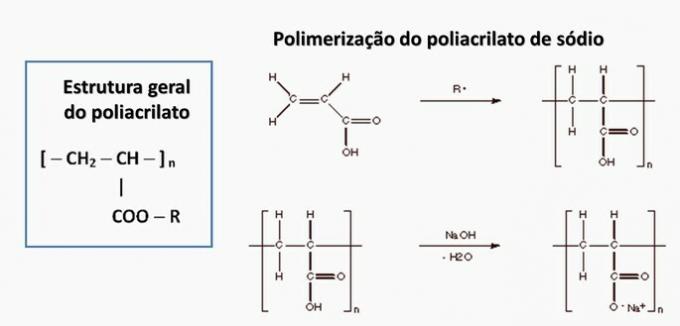
e) FOUT. Polypropyleen wordt gevormd bij de polymerisatie van propyleenmonomeer.
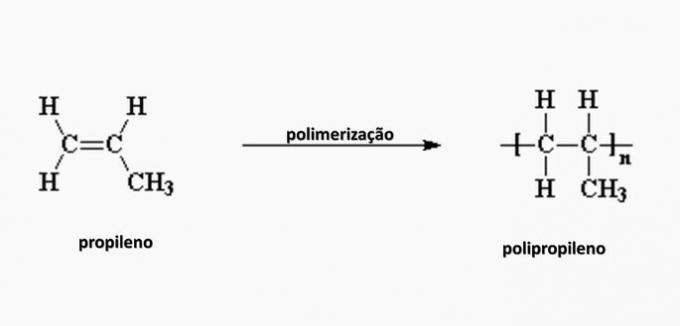
vraag 4
(Enem/2008) China heeft toegezegd Rusland schadeloos te stellen voor het morsen van benzeen uit een industrie Chinese petrochemicaliën in de Songhua-rivier, een zijrivier van de rivier de Amoer, die deel uitmaakt van de grens tussen de twee landen. De president van het Federale Agentschap voor Waterbronnen van Rusland verzekerde dat de benzeen de pijpleidingen van drinkwater, maar vroeg de bevolking om stromend water te koken en vissen in de rivier de Amoer en zijn water te vermijden zijrivieren. Lokale autoriteiten slaan honderden tonnen steenkool op, omdat het mineraal wordt beschouwd als een effectieve benzeenabsorbeerder. Internet: (met aanpassingen). Rekening houdend met de maatregelen die zijn genomen om de schade aan het milieu en de bevolking tot een minimum te beperken, is het juist om te stellen dat:
a) steenkool, wanneer geplaatst in water, reageert met benzeen, waardoor het wordt geëlimineerd.
b) benzeen is vluchtiger dan water en moet daarom worden gekookt.
c) de oriëntatie om vissen te vermijden is te wijten aan de noodzaak om vis te bewaren.
d) benzeen zou de drinkwaterleidingen niet vervuilen, aangezien het op natuurlijke wijze op de bodem van de rivier zou worden gedecanteerd.
e) de vervuiling die wordt veroorzaakt door de benzeenlozing van de Chinese industrie zou beperkt blijven tot de Songhua-rivier.
Correct alternatief: b) benzeen is vluchtiger dan water en moet daarom worden gekookt.
een fout. Steenkool bevat in zijn structuur verschillende poriën en wordt gebruikt als adsorbens, omdat het in staat is om in wisselwerking te treden met verontreinigingen en ze op het oppervlak vast te houden, maar ze niet te elimineren.
b) JUIST. Hoe groter de vluchtigheid van een stof, hoe gemakkelijker deze in een gasvormige toestand verandert. Terwijl het kookpunt van water 100°C is, is dat van benzeen 80,1°C. Dit komt omdat water een polaire verbinding is en benzeen een niet-polaire verbinding.
Het type interacties dat moleculen maken, is verschillend en heeft ook invloed op het kookpunt van stoffen. Het watermolecuul is in staat waterstofbruggen te maken, een soort interactie die veel sterker is dan die welke benzeen, met de geïnduceerde dipool, kan maken.
c) FOUT. In een voedselketen wordt het ene wezen het voedsel van een ander volgens de interacties van soorten op een locatie. Wanneer een giftige stof in een omgeving vrijkomt, is er een progressieve accumulatie en vissen besmet, wanneer het door de mens wordt ingenomen, kan benzeen meenemen en DNA-mutaties veroorzaken en zelfs zelfs kanker.
d) FOUT. Benzeen heeft een lagere dichtheid dan water. De trend is dus dat het zich zelfs onder water blijft verspreiden.
e) FOUT. Seizoensveranderingen kunnen het probleem verder vergroten, omdat lage temperaturen de biologische afbraakcapaciteit van chemicaliën verminderen door de werking van de zon of bacteriën.
vraag 5
(Enem/2019) Koolwaterstoffen zijn organische moleculen met een reeks industriële toepassingen. Ze zijn bijvoorbeeld in grote hoeveelheden aanwezig in verschillende aardoliefracties en worden gewoonlijk gescheiden door gefractioneerde destillatie op basis van hun kooktemperatuur. De tabel geeft de belangrijkste fracties weer die worden verkregen bij de destillatie van aardolie bij verschillende temperatuurbereiken.
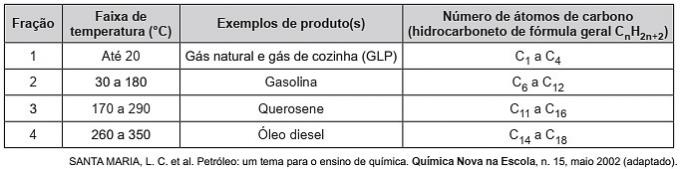
In fractie 4 vindt de scheiding van verbindingen plaats bij hogere temperaturen omdat
a) hun dichtheden zijn groter.
b) het aantal vestigingen is groter.
c) de oplosbaarheid in olie is groter.
d) intermoleculaire krachten zijn intenser.
e) de koolstofketen is moeilijker te doorbreken.
Correct alternatief: d) de intermoleculaire krachten zijn intenser.
Koolwaterstoffen interageren door geïnduceerde dipool en dit type intermoleculaire kracht wordt geïntensiveerd met de toename van de koolstofketen.
Daarom hebben de zwaardere aardoliefracties een hogere kooktemperatuur, omdat de ketens sterker interageren door een geïnduceerde dipool.
Voor meer oefeningen, met een resolutie met commentaar, zie ook:
- Oefeningen over koolwaterstoffen
- Oefeningen over organische functies
- Scheikundevragen in Enem


