Molecuul is een stabiele groepering van twee of meer atomen, hetzelfde of verschillend, verbonden door covalente bindingen.
Moleculaire verbindingen worden geclassificeerd volgens polariteit.
- Apolaire moleculen: er is geen verschil in elektronegativiteit tussen atomen.
- Polaire moleculen: er is een verschil in elektronegativiteit tussen de atomen, met een positieve pool en een negatieve pool.
Wanneer het molecuul wordt gevormd door meer dan één chemisch element, bepaalt het aantal elektronische wolken en liganden naar het centrale atoom de polariteit.
niet-polaire moleculen
Moleculen hebben hun atomen verbonden door covalente bindingen, dat wil zeggen, elektronen worden gedeeld.
elektronegativiteit het is het vermogen van een atoom om elektronen naar zich toe te trekken in een binding, waardoor polen in het molecuul worden gevormd.
Het atoom dat de elektronen aantrekt, wordt de negatieve pool, door de accumulatie van negatieve lading, en het andere atoom wordt de positieve pool.
Wanneer een molecuul wordt gevormd door atomen van een enkel chemisch element, is er geen verschil in elektronegativiteit en is het molecuul
verontschuldigen.
De moleculen van eenvoudige stoffen zoals O2 en nee2, worden gevormd door atomen van hetzelfde element; moleculen van samengestelde stoffen daarentegen hebben minstens twee verschillende elementen.

Bij moleculen CO2 en BeH2 ze zijn ook niet-polair vanwege de geometrie. Omdat beide een lineaire geometrie hebben, trekken de atomen aan de uiteinden, zuurstof en waterstof, de elektronen van de binding naar elkaar toe, omdat ze meer elektronegatief zijn.
De aantrekkingskracht van het atoom aan de linkerkant wordt gecompenseerd door de aantrekkingskracht van het atoom aan de rechterkant. Omdat de bindingen hetzelfde zijn, dat wil zeggen, ze hebben dezelfde intensiteit maar verschillende richtingen, vormen de moleculen geen polen.
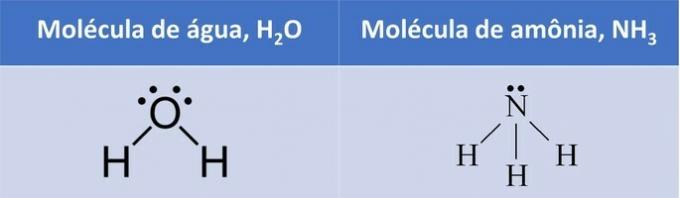
polaire moleculen
Wanneer een molecuul wordt gevormd door verschillende atomen is er een verschil in elektronegativiteit, maar het is de molecuul geometrie die bepaalt of het polair of niet-polair zal zijn.

In beide voorbeelden zien we dat de centrale atomen, zuurstof en stikstof, ongepaarde elektronenparen hebben die elektronenwolken vormen.
Omdat er meer elektronenwolken rond het centrale atoom zijn dan er gelijke atomen aan vast zitten, is het molecuul polair.
Met de vorming van een elektronische wolk neemt het molecuul een structuur aan die beter geschikt is voor de atomen en daarom is de geometrie van water hoekig en ammoniakpiramidaal.
Wil je je kennis verrijken? Mis onderstaande teksten niet!
- Biomoleculen
- intermoleculaire krachten
- moleculaire formule
- Moleculaire massa
Oefening met feedback met commentaar
1. Geef de polariteit van de moleculen aan:

a) Apolair. Het molecuul bestaat uit een enkel chemisch element, chloor. Omdat er geen verschil is in elektronegativiteit, worden er geen polen gevormd.
b) Polair. Er zijn 4 elektronenwolken en 2 gelijke atomen (H) bevestigd aan het centrale element (S).
c) Polair. Er zijn 3 elektronenwolken en 2 gelijke atomen (O) bevestigd aan het centrale element (S).
d) Polair. De elementen van het molecuul hebben verschillende elektronegativiteiten. Een negatieve pool vormt zich in het jodium door de accumulatie van negatieve lading en bijgevolg vormt de waterstofzijde een positieve pool.
e) Polair. Er zijn 4 elektronenwolken en 3 gelijke atomen (Cl) bevestigd aan het centrale element (P).
f) Polair. Er is een asymmetrische verdeling van ladingen op het molecuul, omdat koolstof verschillende liganden heeft.
g) Apolair. Het molecuul is diatomisch en bestaat uit atomen van hetzelfde chemische element, dus er is geen verschil in elektronegativiteit.
h) Apolair. Het aantal elektronenwolken is gelijk aan het aantal atomen dat aan het centrale atoom is bevestigd.
i) Apolair. Het aantal elektronenwolken is gelijk aan het aantal atomen dat aan het centrale atoom is bevestigd.
2. (Fuvest) Beschouw de moleculen van HF, HCl, H2OH2, O2 en CH4.
a) Classificeer deze moleculen in twee groepen: polair en niet-polair.
| Polair | apolair |
|---|---|
| Waterstoffluoride (HF) | Moleculaire waterstof (H2) |
| Waterstofchloride (HCl) | Moleculaire zuurstof (O2) |
| Water (H2O) | Methaan (CH4) |
HF, HCl en H2Ze zijn polair omdat in de drie verbindingen waterstof gebonden is aan zeer elektronegatieve elementen.
H2 het is de2 ze zijn niet-polair, omdat er geen verschil is in elektronegativiteit in de moleculen. de CH4 het is ook niet-polair omdat het aantal elektronenwolken gelijk is aan het aantal elementen dat aan het centrale atoom, koolstof, is bevestigd.
Eigenschap verwijzend naar het atoom: elektronegativiteit.
Moleculen die bestaan uit atomen van slechts één chemisch element zijn geclassificeerd als niet-polair, omdat er geen verschil is in elektronegativiteit.
Eigenschap gerelateerd aan het molecuul: hoeveelheid wolken en aantal gelijke liganden.
Moleculen gevormd door atomen van verschillende chemische elementen werden geclassificeerd als polair of niet-polair volgens het aantal elektronische wolken en de hoeveelheid liganden naar het centrale atoom.
Water is polair omdat het centrale atoom, zuurstof, een ongepaard elektronenpaar heeft, waardoor er 3 elektronenwolken en 2 liganden zijn. Daarom is de verdeling van ladingen asymmetrisch en vormen ze polen in het molecuul.
Methaan is niet-polair, omdat het centrale atoom, koolstof, het aantal liganden heeft dat gelijk is aan het aantal elektronische wolken, waardoor de geometrie tetraëdrisch is en er geen polariteit in het molecuul is.
3. (Vunesp) Geef van de onderstaande alternatieven degene aan met de onjuiste bewering:
a) Covalente binding is er een die optreedt door het delen van elektronen tussen twee atomen.
b) De covalente verbinding HCl is polair vanwege het verschil in elektronegativiteit dat bestaat tussen de waterstof- en chlooratomen.
c) De verbinding gevormd tussen een alkalimetaal en een halogeen is covalent.
d) De stof met formule Br2 het is niet-polair.
e) De substantie van formule Cal2 het is ionisch.
Onjuist alternatief: c) De verbinding gevormd tussen een alkalimetaal en een halogeen is covalent.
a) JUIST. Dit type binding komt overeen met het delen van elektronen in het algemeen tussen niet-metalen.
b) JUIST. Chloor heeft een grotere elektronegativiteit dan waterstof en trekt daarom het elektronenpaar van de binding naar zichzelf, waardoor een onbalans in de lading ontstaat.
Het HCl-molecuul is polair omdat zich in chloor een negatieve pool vormt door de accumulatie van negatieve lading en, bijgevolg heeft de waterstofzijde de neiging een geaccumuleerde positieve lading te hebben, waardoor een pool wordt gevormd positief.
c) ONJUIST. Door ionische bindingen zijn metalen in staat elektronen af te staan en positief geladen te blijven, waardoor kationen worden gevormd; halogenen daarentegen ontvangen elektronen en vormen anionen, soorten met een negatieve lading.
d) JUIST. Het molecuul is diatomisch en bestaat uit atomen van hetzelfde chemische element, dus er is geen verschil in elektronegativiteit.
e) JUIST. Bij ionische binding worden elektronen gedoneerd of ontvangen door atomen. In de ionische verbinding doneert calcium twee elektronen en vormt het kation Ca2+. Jodium ontvangt elektronen uit calcium en vormt een negatief geladen soort, I2-.
Zorg ervoor dat u deze teksten controleert over problemen met betrekking tot het onderwerp van deze inhoud:
- Ionische bindingen
- covalente bindingen
- Polariteit van verbindingen
- Eenvoudige en samengestelde stoffen
- Algemene eigenschappen van materie