Verdamping het is de overgang van de vloeibare toestand naar de gasvormige toestand. Het komt voor op het vrije oppervlak van vloeistoffen, langzaam en geleidelijk, bij elke temperatuur.
Wanneer een stof zich in een vloeibare toestand bevindt, heeft deze een lagere cohesiekracht tussen de atomen dan wanneer deze zich in een vaste toestand bevindt.
In deze toestand bevinden de moleculen zich verder uit elkaar, zijn ze constant in beweging en bewegen ze met verschillende snelheden in de vloeistof.
Op deze manier slagen de deeltjes met grotere snelheid, bij het bereiken van het vrije oppervlak van de vloeistof, erin te ontsnappen en over te gaan naar de gasvormige toestand.

Verdampingssnelheid:
Er zijn factoren die de snelheid waarmee verdamping optreedt beïnvloeden, dit zijn:
- Temperatuur: hoe hoger de temperatuur, hoe sneller de verdampingssnelheid. Want hoe hoger de temperatuur, hoe hoger de kinetische energie van de deeltjes. Op deze manier zullen er meer deeltjes van het vloeistofoppervlak ontsnappen.
- Aard van de vloeistof: er zijn stoffen die makkelijker verdampen, die worden vluchtige stoffen genoemd. Ether, alcohol en aceton zijn voorbeelden van vluchtige stoffen.
- vrije oppervlakte: aangezien verdamping plaatsvindt op het vrije oppervlak van vloeistoffen, hoe groter het oppervlak, hoe groter de hoeveelheid deeltjes die de vloeistof zal verlaten.
- Concentratie van damp op vloeistof: hoe meer stoom, hoe lager de verdampingssnelheid.
- Druk uitgeoefend op de vloeistof: hoe hoger de druk, hoe lager de verdampingssnelheid.
Verschil tussen verdamping en koken
Zowel verdamping als kokend vertegenwoordigen de verandering van de vloeibare toestand naar de gasvormige toestand. Hoewel verdamping geleidelijk plaatsvindt, gebeurt het koken snel.
Om te kunnen koken, moet de vloeistof voor een bepaalde druk een bepaalde temperatuur bereiken, het kookpunt genoemd. Verdamping kan bij elke temperatuur plaatsvinden.
Scheiding van mengsels
Fractionele kristallisatie is een proces waarbij heterogene mengsels worden gescheiden. Het wordt gebruikt wanneer de stoffen waaruit het mengsel bestaat in vaste toestand zijn.
Bij dit proces wordt aan het mengsel een vloeistof toegevoegd die alle vaste componenten oplost. De componenten kristalliseren vervolgens afzonderlijk uit nadat de oplossing is verdampt.
Dit proces wordt bijvoorbeeld toegepast in zoutpannen om zouten uit zeewater te halen.

Verdamping en de watercyclus
Verdamping is een van de processen die de waterfiets. Energie van de zon verwarmt het vrije oppervlak van meren, rivieren, zeeën en oceanen.
Door deze verhitting verdampt een deel van het water tot damp. Dit, bij het bereiken van de hoogste lagen van de atmosfeer, koelt af en condenseert en vormt wolken.
Wanneer er neerslag optreedt, keert het water in vloeibare vorm terug naar de oppervlakte, infiltreert het in de grond en vormt het ondergrondse platen.
Een deel van dit water wordt opgenomen door planten, die de waterdamp door transpiratie terugbrengen naar de atmosfeer.
faseveranderingen
De verandering van een vloeibare naar een gasvormige toestand wordt in het algemeen genoemd verdamping, omdat het naast verdamping nog twee andere processen omvat: koken en verhitten.
Er zijn nog andere processen van staatsverandering. Zijn zij:
- Fusie
- stollen
- Liquefactie of condensatie
- sublimatie
In het onderstaande diagram stellen we de drie fysieke toestanden van materie en de respectievelijke staatswisselingen:
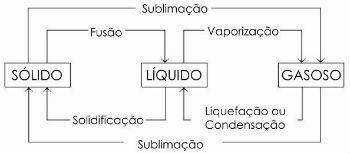
Meer informatie op: Veranderingen in fysieke toestand.



