Chemische isomerie is een fenomeen dat wordt waargenomen wanneer twee of meer organische stoffen dezelfde molecuulformule hebben, maar een verschillende moleculaire structuur en eigenschappen.
Chemische stoffen met deze eigenschappen worden isomeren genoemd.
De term is afgeleid van de Griekse woorden iso = gelijk en louter = delen, dat wil zeggen gelijke delen.
Er zijn verschillende soorten isomerie:
- platte isomeer: Verbindingen worden geïdentificeerd door platte structuurformules. Het is onderverdeeld in keten-isomerisme, functie-isomerisme, positie-isomerisme, compensatie-isomerisme en tautomerisme-isomerisme.
- ruimte isomeer: De moleculaire structuur van verbindingen heeft verschillende ruimtelijke structuren. Het is verdeeld in geometrische en optische isomerie.
platte isomeer
Bij platte isomerie of constitutionele isomerie, de moleculaire structuur van organische stoffen is vlak.
Verbindingen die deze eigenschap vertonen, worden platte isomeren genoemd.
keten isomeer
Ketenisomerie vindt plaats wanneer koolstofatomen verschillende ketens en dezelfde chemische functie hebben.
Voorbeelden:
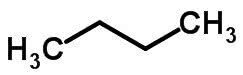
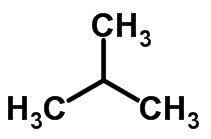
Functie isomerie
Functie-isomerie treedt op wanneer twee of meer verbindingen verschillende chemische functies en dezelfde molecuulformule hebben.
Voorbeelden: Dit geval komt vaak voor tussen aldehyden en ketonen.
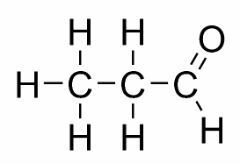
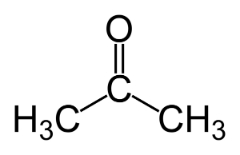
Positie isomeer
Positie-isomerie treedt op wanneer verbindingen worden gedifferentieerd door verschillende onverzadigings-, vertakkings- of functionele groepsposities in de koolstofketen. In dit geval hebben de isomeren dezelfde chemische functie.
Voorbeelden:

compenserende isomeer
Compensatie-isomerie of metamerisme komt voor in verbindingen met dezelfde chemische functie die verschillen door de positie van de heteroatomen.
Voorbeelden:

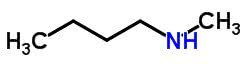
Automatisering
Tautomerie of dynamische isomerie kan worden beschouwd als een specifiek geval van functie-isomerie. In dit geval kan het ene isomeer in het andere veranderen door de positie van een element in de keten te veranderen.
Voorbeelden:

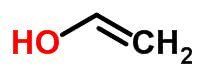
ruimte isomeer
DE ruimte isomerie, ook wel stereo-isomerie genoemd, vindt plaats wanneer twee verbindingen dezelfde molecuulformule en verschillende structuurformules hebben.
Bij dit type isomerie worden atomen op dezelfde manier verdeeld, maar nemen ze verschillende posities in de ruimte in.
geometrische isomeer
DE geometrische isomerie of cis-trans komt voor in onverzadigde open ketens en ook in cyclische verbindingen. Om dit te doen, moeten de koolstofliganden verschillend zijn.

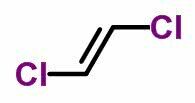
- Wanneer dezelfde liganden zich aan dezelfde kant bevinden, krijgt de isomerennomenclatuur het voorvoegsel cis.
- Wanneer dezelfde liganden zich aan weerszijden bevinden, krijgt de nomenclatuur het voorvoegsel trans.
De IUPAC (International Union of Pure and Applied Chemistry) beveelt aan om in plaats van cis en trans de letters Z en E als voorvoegsel te gebruiken.
Dit komt omdat Z de eerste letter is van het Duitse woord zusammen, wat 'samen' betekent. En het is de eerste letter van het Duitse woord entegegen, wat "tegenover" betekent.
optische isomeer
DE optische isomerie wordt aangetoond door verbindingen die optisch actief zijn. Het gebeurt wanneer een stof wordt veroorzaakt door de hoekafwijking in het vlak van gepolariseerd licht.
- Wanneer een stof optisch licht naar rechts buigt, wordt dit rechtshandig.
- Wanneer een stof optisch licht naar links buigt, wordt de stof genoemd linksdraaiend.
Een stof kan ook voorkomen in twee vormen die optisch actief zijn, dextogyra en levogyra. In dit geval heet het enantiomeer.
Om een koolstofverbinding optisch actief te laten zijn, moet deze chiraal zijn. Dit betekent dat hun liganden elkaar niet kunnen overlappen, omdat ze asymmetrisch zijn.
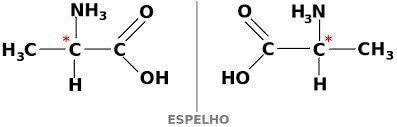
Als een verbinding op zijn beurt de rechtsdraaiende en linksdraaiende vormen in gelijke delen heeft, worden ze racemische mengsels. De optische activiteit van racemische mengsels is inactief.
Lees ook:
- Koolstof
- Organische chemie
- Moleculaire formule
- structurele Formule
Opdrachten
1. (Mackenzie 2012) Nummer kolom B, die organische verbindingen bevat, en associeert ze met kolom A, volgens het type isomerie dat elk organisch molecuul vertoont.
Kolom A
1. compenserende isomeer
2. geometrische isomeer
3. keten isomeer
4. optische isomeer
Kolom B
( ) cyclopropaan
( ) ethoxy-ethaan
( ) broom-chloor-fluor-methaan
( ) 1,2-dichlooretheen
De juiste reeks getallen in kolom B, van boven naar beneden, is
a) 2 - 1 - 4 - 3.
b) 3 - 1 - 4 - 2.
c) 1 - 2 - 3 - 4.
d) 3 - 4 - 1 - 2.
e) 4 - 1 - 3 - 2.
Alternatief b) 3 - 1 - 4 - 2.
2. (Uerj) Isomerie is het fenomeen dat wordt gekenmerkt door het feit dat dezelfde molecuulformule verschillende structuren weergeeft.
Gezien de platte structurele isomerie voor de molecuulformule C4H8, kunnen we isomeren van de volgende typen identificeren:
a) ketting en positie
b) keten en functie
c) functie en compensatie
d) positie en compensatie
Alternatief a) string en positie
3. (OSEC) Propanon en isopropenol zijn voorbeelden van een geval van isomerie:
a) van metameria
b) van functie
c) van tautomerie
d) cis-tran
e) ketting
Alternatief c) van tautomerie
Zie ook: Oefeningen over platte isomerie



