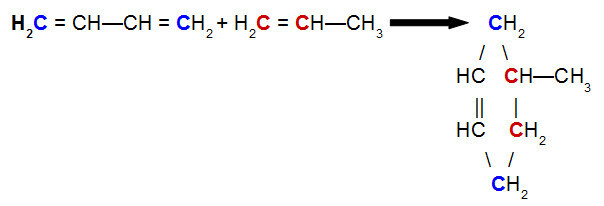Structuurformule is het schema dat de structuur aangeeft, dat wil zeggen de rangschikking van de atomen waaruit de chemische elementen bestaan, evenals de verbinding daartussen. Het kan op verschillende manieren worden weergegeven: plat, gecondenseerd of elektronisch.
Van de factoren die de gebruikte structuren conditioneren, is het aantal elektronen in de valentieschil er een van.
Platte formule
De platte formule gebruikt streepjes om covalente bindingen weer te geven, die enkel, dubbel of drievoudig kunnen zijn en op de volgende manieren kunnen worden weergegeven:
– eenvoudige aansluiting (wanneer 2 elektronen worden gedeeld)
= dubbele binding (wanneer 4 elektronen worden gedeeld)
≡ drievoudige link (wanneer 6 elektronen worden gedeeld)
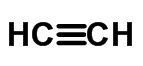
Verkorte of vereenvoudigde formule
In de verkorte structuurformule zijn de bindingen niet weergegeven.
In zijn weergave wordt het aantal atomen van elk element op een gecondenseerde manier aangegeven, dat wil zeggen vereenvoudigd:
H3C CH2 de CH2 CH3
Lineaire gecondenseerde formule
De lineaire gecondenseerde formule gebruikt zigzaglijnen, op wiens hoekpunten de koolstoffen worden weergegeven:
Elektronische of Lewis-formule
De elektronische formule, ook wel de Lewis-formule genoemd, wordt weergegeven door punten.
Door deze punten worden de hoeveelheden elektronen weergegeven die aanwezig zijn in de valentielagen:
H: H
En de molecuulformule?
DE moleculaire formule, zonder te verwijzen naar de structuur, geeft het aantal elementen aan waaruit a. bestaat molecuul. Naast het aangeven van het aantal atomen dat in elk element aanwezig is en hun verhoudingen.
Het kan worden verkregen door de minimum- of empirische formule en de percentage- of centesimale formule.
Lees ook isomerie en Valencia laag.
Opgelost Oefeningen
1. (Vunesp-2000) Schrijf de structuurformule en geef de officiële naam:
a) een verzadigd keton met vertakte koolstofketen met in totaal 7 koolstofatomen.
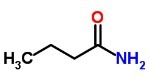
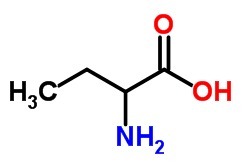
b) een aminozuur, met 4 koolstofatomen.
De)

B)
2. (FGV-2005) Aspartaam is een kunstmatige zoetstof die in 1965 per ongeluk werd ontdekt door een onvoorzichtige chemicus, die zijn vuile vingers likte en vond dat ze zoet waren.
Deze onhygiënische gewoonten worden niet aanbevolen, omdat veel stoffen in minieme hoeveelheden zeer giftig zijn.
De structuurformule voor aspartaam wordt hieronder weergegeven:

Uit de structuurformule van aspartaam blijkt dat er
a) 13 koolstofatomen per molecuul.
b) 1 functionele ethergroep.
c) 1 dipeptide
d) 2 tertiaire koolstofatomen
e) slechts 1 asymmetrisch koolstofatoom.
Alternatief c: 1 dipeptide
Zie ook deze oefenlijsten om je kennis te blijven testen:
- Oefeningen over koolwaterstoffen
- Oefeningen over organische chemie
- Oefeningen over platte isomerie