Aminen zijn stikstofhoudende organische verbindingen die zijn afgeleid van de stof ammoniak (NH3) door een of meer waterstofatomen te vervangen door organische radicalen. Volgens de hoeveelheid gesubstitueerde waterstofatomen, aminen kan worden ingedeeld in:
Primair amine: gevormd door een waterstofatoom in ammoniak te vervangen door een organisch radicaal;
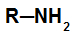
Algemene structuur van een primair amine
Secundaire amine: gevormd door de vervanging van twee ammoniakwaterstoffen door twee organische radicalen.

Algemene structuur van een secundair amine
Tertiair amine: gevormd door de drie waterstofatomen van ammoniak te vervangen door drie organische radicalen.

Algemene structuur van een tertiair amine
Fysieke kenmerken van aminen
Het zijn polaire verbindingen;
Primaire en secundaire amines kunnen presteren waterstofbruggen;
Tertiaire aminen voeren interactie uit permanente dipool;
Aminen met maximaal vijf koolstofatomen zijn oplosbaar in water en ethanol. Aminen met zes of meer koolstofatomen zijn praktisch onoplosbaar in water, maar oplosbaar in organische oplosmiddelen;
Aminen met een aromatische structuur zijn dichter dan water;
Aminen met één tot drie koolstofatomen zijn gasvormig bij kamertemperatuur. Die met vier tot twaalf koolstofatomen zijn vloeibaar bij kamertemperatuur;
Over het algemeen hebben aminen alleen hogere smelt- en kookpunten in verhouding tot een niet-polaire organische verbinding.
Chemische eigenschappen van aminen
Ze worden beschouwd als organische basen, volgens de Bronsted-Lowry-theorie;
Aromatische aminen hebben een lager basisch karakter door het fenomeen van resonantie;
Hoe groter het basische karakter van het amine, hoe groter de kans dat het reageert met een bepaalde stof;
In aanwezigheid van een zuur voeren aminen neutralisatie-reactie, omdat ze een basiskarakter hebben.
regel van amine nomenclatuur
Om een amine te noemen, volgt u gewoon de regel die is opgesteld door de International Union of Pure and Applied Chemistry (IUPAC), hieronder beschreven:
Naam van de radicaal of radicalen + amine
OPMERKING: Als het amine verschillende radicalen heeft, moeten we de alfabetische volgorde volgen.
Volg enkele voorbeelden:
Voorbeeld 1: primaire amine

In het primaire amine in dit voorbeeld hebben we de aanwezigheid van een propylradicaal, dus de naam is propylamine.
Voorbeeld 2: secundair amine

In het secundaire amine in dit voorbeeld hebben we de aanwezigheid van de methylradicaal (links van stikstof) en de ethylradicaal (rechts van de stikstof). De naam is, in alfabetische volgorde, ethyl-methylamine.
Voorbeeld 3: tertiair amine
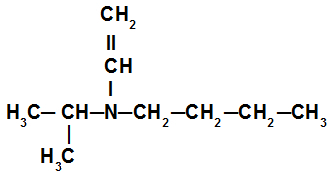
In het secundaire amine in dit voorbeeld hebben we de isopropylradicaal (links van stikstof), de butylradicaal (rechts van de stikstof) en de vinylradicaal (onder de stikstof). De naam is daarom butyl-isopropyl-vinylamine.
Amine-toepassingen
Op grote schaal gebruikt bij de productie van verschillende organische verbindingen;
Gebruikt bij de vervaardiging van zepen;
Gebruikt in het rubbervulkanisatieproces;
Gebruikt bij de vervaardiging van kleurstoffen.
Door mij Diogo Lopes Dias
Bron: Brazilië School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-sao-aminas.htm
