Volgens het model van orbitalen gemaakt door Linus Pauling in 1960, is de covalente binding die de. vormt moleculen vindt plaats door de fusie of interpenetratie van onvolledige orbitalen van de elementen die betrokken zijn bij de Koppeling. Er wordt dus geconcludeerd dat als het element een onvolledige orbitaal heeft (met slechts één elektron), het alleen een covalente binding kan maken. Als het twee onvolledige orbitalen heeft, kan het maximaal twee verbindingen maken, enzovoort.
Kijk echter naar de atomaire orbitalen van het element koolstofatoom, waarvan het atoomnummer gelijk is aan 6 (Z = 6):
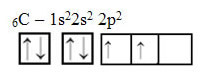
Merk op dat het twee onvolledige orbitalen heeft, dus het zou maximaal twee bindingen moeten uitvoeren. Dat is echter niet wat hem overkomt. Zoals velen weten, maakt koolstof vier bindingen (het is vierwaardig), dus dit model van orbitalen verklaart het geval van koolstof niet.
Om deze impasse te beëindigen, werd een nieuwe theorie gecreëerd die dit probleem beter verklaarde: de Hybridisatie theorie.

Dit betekent dat hybridisatie een "mix" is van pure orbitalen.
Voor koolstof zijn er drie soorten hybridisatie, namelijk: sp3, sp2 en sp.
Laten we, om te begrijpen hoe hybridisatie plaatsvindt, kijken naar het eerste type koolstofhybridisatie, het sp-type.3:
Dit type hybridisatie vindt plaats in het methaanmolecuul (CH4). Merk op dat er vier identieke covalente bindingen zijn tussen koolstof, het centrale element, en vier waterstofatomen. Dus, kijk wat de onvolledige waterstoforbitaal is:
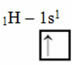
Omdat elke waterstof een onvolledige orbitaal van het s-type heeft, is het nodig om nog een elektron te ontvangen, dat wil zeggen dat elke waterstof slechts één covalente binding met de koolstof maakt. Daarom moet koolstof vier onvolledige orbitalen hebben. Hoe gebeurde dit? Door hybridisatie.
Wanneer een elektron uit de 2s-orbitaal energie absorbeert, gaat het over in de lege 2p-orbitaal. We zeggen dus dat deze sprong van het elektron van het 2s naar het 2p-subniveau een "promotie" van het elektron is. Op deze manier blijft de koolstof in zijn aangeslagen of geactiveerde toestand, met vier gehybridiseerde orbitalen beschikbaar om de covalente bindingen uit te voeren:
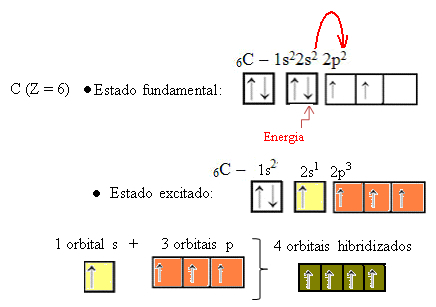
Merk op dat de gevormde hybride orbitalen gelijkwaardig zijn aan elkaar, maar verschillen van de oorspronkelijke zuivere orbitalen.
Op deze manier vindt de binding tussen de s-orbitaal van elk van de vier waterstofatomen plaats met deze vier gehybridiseerde koolstoforbitalen:
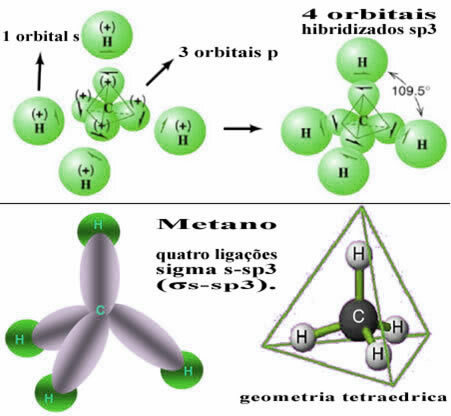
Zoals hierboven te zien is, heeft het methaanmolecuul een regelmatige tetraëderstructuur, met de vier elektronenwolken op elk hoekpunt en aangrenzende hoeken van 109°28'. Omdat de binding is gemaakt tussen een s-orbitaal van elke waterstof en een gehybridiseerde sp-orbitaal3 voor elke oproep, dan hebben we dat ze zijn four sigma s-sp links3 (σs-sp3).
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp3.htm
