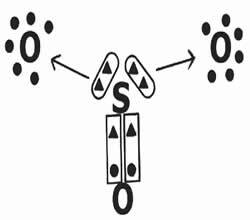
Koolmonoxide is een kleurloos, geurloos, ontvlambaar en giftig gas.
De molecuulformule is CO. Het bestaat uit een koolstof- en zuurstofmolecuul.
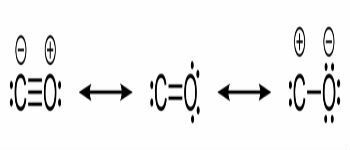
Structuurformules van koolmonoxide en chemische bindingen tussen koolstof en zuurstof
Het ontstaat op twee manieren:
- Natuurlijke uitzendbronnen: activiteit van vulkanen, aardgas en elektrische ontladingen.
- menselijke activiteiten: resultaat van verbranding onvolledige fossiele brandstoffen. Verbranden produceert tonnen CO, wat een van de belangrijkste activiteiten is waarbij CO vrijkomt in de atmosfeer.
Kenmerken
Koolmonoxide behoort tot de groep van oxiden. Het is geclassificeerd als: neutraal oxide, die gevormd door een metaal plus zuurstof. Verder reageert het niet met water, zuren en basen.
Het wordt gebruikt als reductiemiddel, het verwijdert zuurstof uit een verbinding en produceert de kooldioxide (CO2). Daarom is het gebruik ervan bij de verwerking van ertsen, zoals ijzer, heel gebruikelijk. Evenals bij de productie van organische stoffen, zoals azijnzuur, kunststoffen, methanol, onder andere.
Wanneer het reageert met zuurstof in de lucht, produceert het koolstofdioxide. Volgens de volgende chemische reactie: 2 CO + O2 → 2 CO2
In oppervlaktewateren dient de hoge concentratie koolmonoxide als energiebron voor micro-organismen.
Koolmonoxide is een van de gassen van broeikaseffect. De concentratie ervan in de atmosfeer draagt bij tot een grotere warmteopslag. Het wordt daarom beschouwd als een vervuilend gas.
Intoxicatie
CO heeft een hoge affiniteit voor hemoglobine. Omdat het giftig is, veroorzaakt de inademing ervan effecten op de menselijke gezondheid en kan het zelfs tot de dood leiden.
Omdat CO geen geur heeft, kan het ongemerkt worden ingeademd. Daarom duurt het in sommige gevallen lang voordat de persoon de intoxicatie opmerkt.
Bij inademing bij lage concentratie veroorzaakt het migraine, traag denken, oogirritatie en verlies van handvaardigheid. In hoge concentraties kan het epileptische aanvallen, bewustzijnsverlies en zelfs de dood door verstikking veroorzaken.
Maar hoe ontstaat dronkenschap?
DE hemoglobine sluit natuurlijk aan op de O2 en transporteert het naar lichaamsweefsels. De affiniteit tussen CO en hemoglobine is echter veel groter, ongeveer 250 keer meer dan bij O2.
In aanwezigheid van CO bindt hemoglobine eraan, waardoor het transport van zuurstof naar cellen wordt voorkomen. De combinatie van CO met hemoglobine geeft aanleiding tot carboxyhemoglobine.
De belangrijkste oorzaken van CO-vergiftiging komen voor in de volgende situaties:
- Automotoren die binnen draaien;
- Verbranding van natuurlijk gas in inefficiënte kachels;
- Gasafvoer uit keuken of houtoven, in slecht geventileerde ruimtes.
In landen met een koud klimaat blijven huizen vaak langer gesloten en gebruiken ze verwarmingssystemen. Om gasongevallen te voorkomen, worden steeds vaker CO-detectoren gebruikt.
Lees meer, lees ook:
- koolstof cyclus
- Koolstof
- Fossiele brandstoffen
- Zuurstof