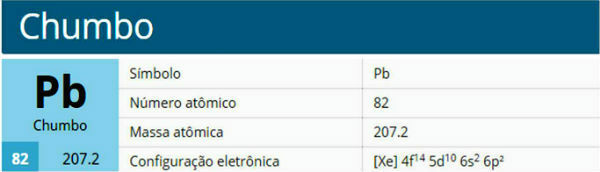
Lood is een scheikundig element met atoomnummer 82, atoommassa 207,2 en behoort tot groep 14 van het periodiek systeem.
Het wordt gekenmerkt door een zwaar, giftig en smeedbaar metaal te zijn.
Bij kamertemperatuur wordt het gevonden in een vaste toestand, met een blauwachtig witte kleur en die in contact met lucht grijsachtig wordt. Het is ook een slechte geleider van elektriciteit en zeer goed bestand tegen corrosie.
Lood in zijn elementaire vorm wordt zelden in de natuur gevonden. Het is dus gebruikelijker om het te vinden in mineralen zoals galena, anglesiet en cerusiet.
toepassingen
Lood heeft verschillende soorten toepassingen en wordt in tal van producten aangetroffen. Het is een metaal dat al sinds de oudheid door de mens wordt gebruikt.
We kunnen de aanwezigheid en het nut van lood in verschillende industrieën en producten opsommen:
- Diverse apparatuur en gebruiksvoorwerpen in de industrie en de bouw;
- Munitie;
- Cosmetica en pigmenten, met name lippenstiften en haarkleurmiddelen. Vanwege de toxiciteit hebben sommige landen de aanwezigheid ervan in cosmetica verboden;
- Metaallegeringen;
- Brandstof additief. In 1992 verbood Brazilië het gebruik van lood in benzine, omdat het milieuvervuiling veroorzaakt wanneer het in de lucht komt.
- Stralingsafschermende dekens;
- Productie van laswerk.
Lees ook over:
- Chemische elementen
- Periodiek systeem
Intoxicatie
Lood is een schadelijk element voor de menselijke gezondheid en contact met het metaal vindt oraal, ingeademd of via de huid plaats.
Kinderen en zwangere vrouwen zijn vatbaarder voor loodvergiftiging.
Sommige gevallen van vergiftiging kunnen optreden door huishoudelijk gebruiksvoorwerpen bedekt met keramisch email op koperbasis. Als het in contact komt met zure stoffen, kan lood uitspoelen naar voedsel.
Het is belangrijk om te benadrukken dat lood in de loop van de tijd niet ontleedt en ook niet wordt afgebroken door het effect van warmte. Bovendien heeft het het vermogen om zich op te hopen in het lichaam, vooral in de nieren, lever, hersenen en botten.
Lood kan braken, buikpijn, toevallen, encefalopathie, spierzwakte en nier-, lever- en hersenbeschadiging veroorzaken.
Het loodgehalte in het lichaam kan worden gecontroleerd met een bloedonderzoek en in sommige gevallen röntgenfoto's. De dronken persoon moet medische hulp krijgen.


