U oxiden ze bestaan uit twee verschillende elementen, waarvan er één zuurstof is, die de meest elektronegatieve van de twee moet zijn.
De nomenclatuur van anorganische oxiden volgt regels die afhangen van het feit of het oxide moleculair, covalent of ionisch is. Laten we naar elk geval kijken:
* Nomenclatuur van moleculaire oxiden of covalent netwerk:
Moleculaire of covalente netwerkoxiden zijn die met zuurstof aan a ametaal, zoals koolstof (C), stikstof (N), zwavel (S), fluor (F), onder anderen. De nomenclatuur van deze oxiden volgt de volgende regel:

Nomenclatuurregel voor oxiden gevormd met ametalen
Het mono-voorvoegsel voor het zuurstofgebonden element is optioneel.
We hebben bijvoorbeeld het volgende moleculaire oxide: CO.
- Prefix die de hoeveelheid zuurstof aangeeft: 1 zuurstof: mono;
- oxide van;
- Prefix dat het aantal atomen van het andere element aangeeft: 1 koolstof: mono;
- Naam van het aan zuurstof gekoppelde element: koolstof.
Dus je naam is als volgt: CO = monokoolmonoxide of koolmonoxide.
Zie meer voorbeelden:
kooldioxide - CO2
Zwaveltrioxide - SO3
Dichloorheptoxide - Cl2O7
Distikstofmonoxide - N2O
Distikstoftrioxide - N2O3
Stikstofmonoxide -NO
Stikstofdioxide - NO2
Distikstofpentoxide - N2O5
Siliciumdioxide - SiO2
Difosforpentoxide - P2O5
Zwaveltrioxide - SO3
* Nomenclatuur van ionische oxiden:
Ionische oxiden zijn die met zuurstof gebonden aan a metaal, zoals ijzer (Fe), lood (Pb), natrium (Na), calcium (Ca), zilver (Ag), onder anderen. Over het algemeen is de elektrische lading van zuurstof -2.
De genoemde nomenclatuur voor moleculaire of covalente netwerkoxiden wordt momenteel ook toegepast op metaaloxiden en wordt als officieel beschouwd. Zie enkele voorbeelden:
IJzermonoxide - FeO
Loodmonoxide - PbO
Looddioxide - PbO2
Diferous trioxide - Fe2O3
Er is echter een specifieke nomenclatuur voor metaaloxiden die nog steeds veel wordt gebruikt. Het is gebaseerd op de valentie van het element gekoppeld aan zuurstof.
Als het element heeft een enkele valentie, dat wil zeggen, als er maar één manier is om zuurstof te binden en slechts één type oxide te vormen, wordt de naamregel gegeven door:

Naamgevingsregel voor enkelvoudig ionisch oxide
Voorbeelden:
- Natriumoxide - Na2O
- Calciumoxide - CaO
- Kaliumoxide - K2O
- Aluminiumoxide - Al2O3
- Zilveroxide - Ag2O
Maar er zijn ook ionische oxiden gevormd door elementen met meer dan één valentie. In deze gevallen is de naamgevingsregel als volgt:
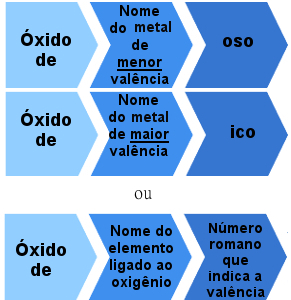
Nomenclatuurregel voor ionoxiden met meer dan één valentie
Voorbeelden:
IJzeroxide - FeO
IJzeroxide - Fe2O3
Koperoxide - Cu2O
koperoxide - CuO
Of:
IJzeroxide II - FeO (Iron nox = +2)
IJzeroxide III - Fe2O3 (IJzernox = +3).
Koperoxide I - Cu2O (IJzernox = +1)
Koperoxide II - CuO (Iron nox = +2).
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/nomenclatura-dos-oxidos.htm

