Apolair is de kwaliteit van wat heeft geen polariteit, meestal gerelateerd aan organische moleculen.
In de chemie is de polariteit van organische moleculen gerelateerd aan de intensiteit van elektronegativiteit van de atomen waaruit deze moleculen bestaan. Wanneer er geen verschil is tussen de elektronegativiteit van atomen, wordt dit molecuul als niet-polair beschouwd.
In een niet-polair molecuul is het verschil in elektronegativiteit van de binding van atomen moet altijd nul zijn, zoals ze tenietdoen.
Normaal gesproken zijn niet-polaire verbindingen gemaakt van: Koolwaterstoffen, dat wil zeggen verbindingen gevormd door koolstofatomen of / en waterstof.
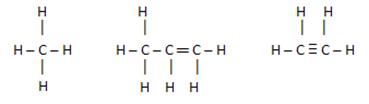
Deze verbindingen hebben vergelijkbare elektronenladingen, dus er is geen ladingsverschuiving tussen hen, maar de vernietiging van deze ladingen.
Zie ook de betekenis van molecuul.
Wanneer er bijvoorbeeld verschillende organische verbindingen in een koolwaterstofbinding zitten, wordt deze al als polair beschouwd.
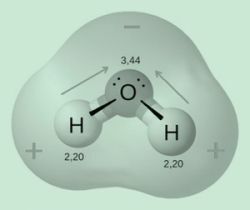 Voorbeeld: de moleculaire geometrie van water (H2O) wordt gevormd door twee waterstofatomen en één zuurstofatoom, namelijk: dat de elektronen in deze verbinding meer geconcentreerd zijn in de zuurstof, waardoor er een verplaatsing is van ladingen. Zuurstof wordt dus meer elektronegatief dan waterstof, waardoor dit molecuul als polair wordt gekenmerkt.
Voorbeeld: de moleculaire geometrie van water (H2O) wordt gevormd door twee waterstofatomen en één zuurstofatoom, namelijk: dat de elektronen in deze verbinding meer geconcentreerd zijn in de zuurstof, waardoor er een verplaatsing is van ladingen. Zuurstof wordt dus meer elektronegatief dan waterstof, waardoor dit molecuul als polair wordt gekenmerkt.
Met andere woorden, water is een polaire verbinding.
meer weten over Koolwaterstoffen.
niet-polair en polair
In tegenstelling tot niet-polaire verbindingen, polaire moleculen zijn moleculen met een elektronegativiteit die niet nul is tussen atomen.
Vanwege verschillende elektronendichtheden accumuleren sommige atomen meer elektronen dan andere, waardoor de aantrekkingskracht intenser wordt.
Enkele van de belangrijkste niet-polaire verbindingen zijn: benzine, methaan en ethaan.
Enkele van de belangrijkste polaire verbindingen zijn: water, suiker en alcohol.