Eiwitten zijn essentiële voedingsstoffen voor het menselijk lichaam, bestaande uit biologische macromoleculen gevormd door een of meer ketens van aminozuren.
Meer dan de helft van het droge gewicht van cellen in alle levende wezens bestaat uit eiwitten, de belangrijkste biologische macromoleculen.
Deze macromoleculen worden overvloedig aangetroffen in voedingsmiddelen van dierlijke oorsprong.
Eiwit samenstelling
De samenstelling en andere kenmerken van eiwitten zijn het onderwerp van studie in de biochemie, een subdiscipline van de biologie.
De samenstelling van eiwitten heeft koolstof, waterstof, stikstof- en zuurstof en in praktisch allemaal is er ook de aanwezigheid van zwavel. Elementen zoals ijzer, zink en koper mag ook aanwezig zijn.
Eiwitten zijn in principe samengesteld uit een reeks aminozuren die covalent aan elkaar zijn gekoppeld.
Een lange keten van aminozuren is a polypeptide.
Deze bindingen tussen aminozuren worden peptidebindingen.
Peptidebindingen treden op als een reactie tussen de groep
de mijn (organische verbinding afgeleid van ammoniak) van een aminozuur en de groep carboxyl (carbonzuurcomponent) van anderen.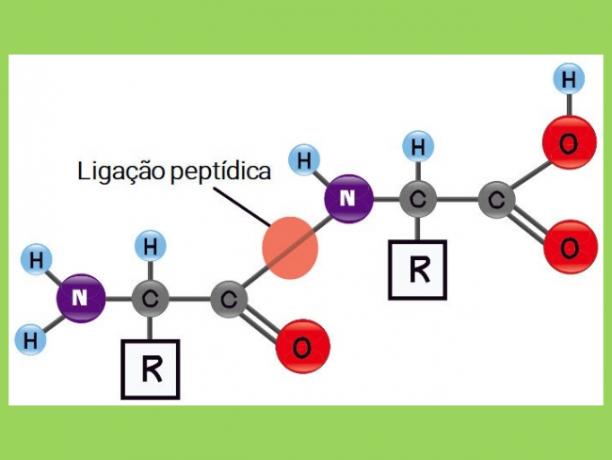
C = koolstof; H = waterstof; O = zuurstof; N = Stikstof; R = Groep R of zijketen (aminozuuridentiteit).
Er zijn 20 aminozuren die op verschillende manieren kunnen worden gecombineerd om verschillende soorten eiwitten te vormen.
meer weten over aminozuren.
Soorten eiwitten
Eiwitten kunnen worden ingedeeld in twee groepen op basis van hun functie in het lichaam: dynamische eiwitten en structurele eiwitten.
dynamische eiwitten
Dynamische eiwitten hebben als functie het lichaam te verdedigen, stoffen te transporteren, reacties te katalyseren en de stofwisseling te reguleren.
structurele eiwitten
Structurele eiwitten hebben als belangrijkste functie het vormen van de structuur van cellen en weefsels in het lichaam.
Eiwitclassificatie
De classificatie van eiwitten varieert afhankelijk van de belangrijkste factor waarmee rekening wordt gehouden.
Samenstelling classificatie
Wanneer het object van studie de samenstelling van eiwitten is, kunnen ze in twee groepen worden ingedeeld:
- eenvoudige eiwitten: zijn die welke alleen aminozuren vrijgeven tijdens hydrolyse.
- geconjugeerde eiwitten: eiwitten die bij hydrolyse aminozuren en een niet-peptide radicaal afgeven.
Rangschikking op aantal polypeptideketens
Met betrekking tot het aantal polypeptideketens kunnen eiwitten worden geclassificeerd als:
- monomere eiwitten: zijn eiwitten die maar één polypeptideketen hebben.
- oligomere eiwitten: zijn eiwitten gevormd door meer dan één polypeptideketen.
Classificatie op formulier
Met betrekking tot vorm kunnen eiwitten in twee soorten worden ingedeeld:
- Vezelige eiwitten: In vezelachtige eiwitten krullen de polypeptideketens op als een touw. Een van de kenmerken van vezelachtige eiwitten is dat ze niet oplosbaar zijn in waterige oplossingen. Bovendien zijn ze verantwoordelijk voor de sterkte en flexibiliteit van de structuren waar ze aanwezig zijn. Voorbeelden van vezelachtige eiwitten: keratine, collageen
- Bolvormige eiwitten: de polypeptideketens van bolvormige eiwitten vouwen zich in vorm ongeveer bolvormig of zoals de naam al aangeeft, bolvormig, waardoor ze lijken op een wereldbol. Bolvormige eiwitten zijn meestal oplosbaar in waterige oplossingen. Voorbeelden van bolvormige eiwitten: hemoglobine, enzymen.
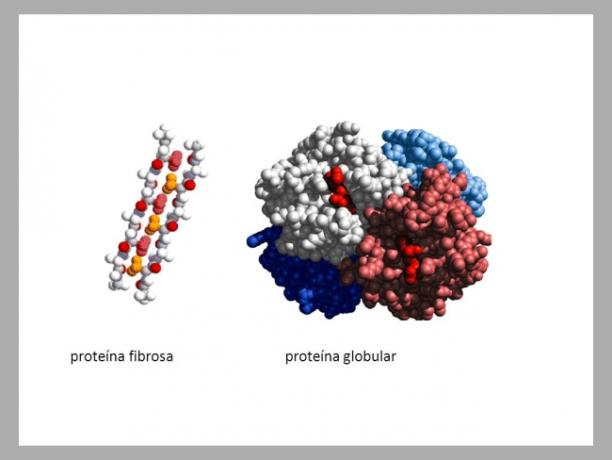
Afbeeldingen van een vezelig eiwit en een bolvormig eiwit
meer weten over hemoglobine en enzym.
eiwit structuur
Met betrekking tot de structuur van het eiwitmolecuul, zie hoe het kan worden ingedeeld:

primaire structuur
De primaire structuur is genetisch bepaald. Het is de eenvoudigste structuur van allemaal, waarbij de aminozuren op een lineaire manier zijn gerangschikt.
secundaire structuur
Om een eiwitstructuur secundair te laten zijn, moet de primaire structuur aminozuren bevatten die covalent aan elkaar zijn gekoppeld. Daarom kunnen moleculen rotaties ondergaan en uiteindelijk op drie manieren met zichzelf interageren:
- alfa-helix: neemt spiraalvorm aan wanneer waterstofbruggen tussen aminozuren optreden.
- bètabladen: wanneer er waterstofbruggen zijn tussen aminozuren en de daaruit voortvloeiende vorming van een vel en een stijve structuur.
- stropdassen: het zijn niet-regelmatige structuren in de kern en hun vorming vindt plaats buiten de eiwitvouwing.
tertiaire structuur
Het treedt op wanneer het ontvouwen van de secundaire structuur op een driedimensionale manier in de ruimte wordt gerangschikt.
quaternaire structuur
Deze structuur vindt plaats door een interactie tussen identieke of niet identieke polypeptideketens, die zich groeperen en een enkele driedimensionale structuur vormen.
Eiwitfuncties
Eiwitten spelen een fundamentele rol in het lichaam. Ze vormen de basis voor het materiaal dat organen en weefsels vormt, evenals de basis voor de vorming van botten, haar, tanden, enz.
De functie van het eiwit is afhankelijk van zijn vorm en structuur. Vrijwel alle celfuncties moeten worden gemedieerd door eiwitten.
Bekijk hieronder enkele van de belangrijkste functies van eiwitten.
- Structureer de cellen.
- Werken als enzymen en versnellen daardoor chemische reacties.
- Transporteren van moleculen en ionen.
- Stoffen opslaan.
- Help de beweging van cellen en weefsels.
- Bouw en herstel weefsel en spieren.
- Doe mee aan genregulatie.
- Veroorzaak spiercontractie door de werking van twee soorten eiwitten: myosine en acteren.
- Verdedig het lichaam (antilichamen zijn soorten eiwitten).
- Zuurstof vervoeren (hemoglobine is het eiwit dat zuurstof door het lichaam transporteert).
- Zorg voor energie.
- Handelend in de regulatie van het metabolisme in de vorm van hormonen.
Eiwitkenmerken
Een van de belangrijkste kenmerken van eiwitten is een vermogen genaamd denaturatie. Denaturatie is de onomkeerbare verandering in de eigenschappen van eiwitten wanneer ze worden verwarmd of geroerd.
Wat het menselijk lichaam betreft, is het de tweede grootste component van het organisme, de tweede alleen voor water.
De kenmerken van eiwitten verschillen naargelang hun herkomst: die van dierlijke oorsprong hebben een hogere biologische waarde; ze worden beschouwd als complete eiwitten, met alle essentiële aminozuren in optimale hoeveelheden en verhoudingen.
Eiwitten en voeding
Wanneer we voedsel eten, vindt het gebruik van eiwitten door ons lichaam plaats via de spijsvertering.
Bij de spijsvertering worden eiwitten blootgesteld aan een zuur en hydrolyse en zo gebeurt jouw denaturatie.
Bij blootstelling aan extreme hitte en beweging ondergaan secundaire en tertiaire structuren onomkeerbare veranderingen en verliezen daardoor hun eigenschappen. Om deze reden verliezen bepaalde voedingsmiddelen hun voedingskracht wanneer ze worden gekookt.
Eiwitten kunnen van dierlijke en plantaardige oorsprong zijn.
Ken de belangrijkste kenmerken van deze eiwitten.
| dierlijke eiwitten | plantaardige eiwitten |
|---|---|
| Ze hebben een hoge biologische waarde. Het zijn complete eiwitten, met alle essentiële aminozuren in ideale hoeveelheden en verhoudingen. | Ze hebben een lage biologische waarde, dat wil zeggen dat de hoeveelheid essentiële aminozuren lager is. |
| Ze hebben een grotere hoeveelheid stikstof in vergelijking met plantaardige eiwitten. | In vergelijking met dierlijke eiwitten hebben ze een grotere hoeveelheid van het aminozuur arginine, waardoor het immuunsysteem effectiever wordt. |
| Ze zijn rijk aan calcium, ijzer, vitamine B12 en zink. | Ze zijn rijk aan koolhydraten en vitamines. |
| Ze bevatten veel schadelijk vet. | Ze bevatten geen schadelijk vet. |
| Ze hebben weinig vezels. | Ze zijn rijk aan vezels. |
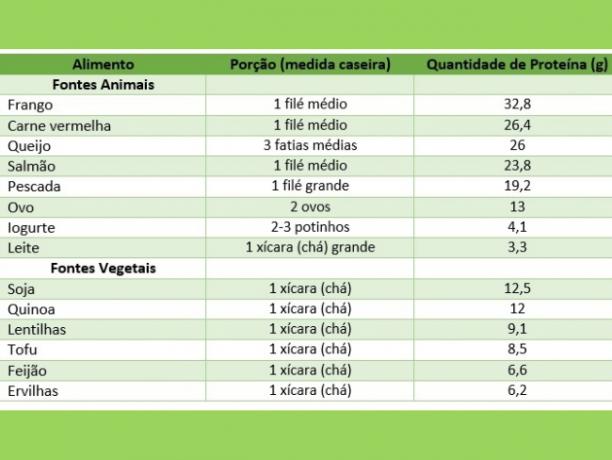
Voedingsmiddelen rijk aan dierlijke eiwitten
Hieronder vindt u een lijst met voorbeelden van eiwitrijke voedingsmiddelen van dierlijke oorsprong.
- Tonijn
- Garnalen
- rood vlees
- Kip
- Eieren
- Peru
- Varken
- Yoghurt
Voedingsmiddelen rijk aan plantaardige eiwitten
Hieronder vindt u een lijst met voorbeelden van eiwitrijke voedingsmiddelen van plantaardige oorsprong.
- Amandel
- Pinda
- bruine rijst
- Haver
- Broccoli
- Erwt
- Spinazie
- gebakken bonen
- linzen
Onder plantaardig voedsel zijn er ook enkele: eiwitrijk fruit:
- Avocado
- Gedroogde pruim
- Banaan
- droge abrikoos
- Afb
- Framboos
- Guave
- Jabuticaba
- jackfruit
- Oranje
- Meloen
- Passeer druif
eiwitvertering
Het eiwitverteringsproces begint in de maag. Het daarin aanwezige zoutzuur start het proces door de eiwitten te denatureren, dat wil zeggen door de waterstofbruggen in hun structuur te vernietigen.
Daarna verliezen de proteolytische ketens hun vorm en worden ze onderworpen aan de werking van enzymen. Op dit punt zorgt het pepsine-enzym ervoor dat de eiwitten kleinere moleculen worden, dwz de pepsine veroorzaakt een gedeeltelijke afbraak van het eiwit en hydrolyseert de peptidebindingen.
De tweede fase van de eiwitvertering vindt plaats in de dunne darm. Daarin worden eiwitten onderworpen aan de acties van pancreasenzymen. Daarna worden de peptiden en aminozuren geabsorbeerd en naar de lever gebracht.

Enzymen die deelnemen aan de eiwitvertering
Het percentage eiwit dat door het lichaam in de vorm van ontlasting wordt afgegeven, komt overeen met ongeveer 1% van de ingenomen hoeveelheid.
eiwitsynthese
Eiwitsynthese is een door DNA bepaald proces waarbij biologische cellen nieuwe eiwitten genereren. Dit komt voor in elke cel in het lichaam.
Tijdens het proces is er een transcriptie van het DNA door het boodschapper-RNA en vervolgens een vertaling van deze informatie door de ribosomen en het transporter-RNA, dat de aminozuren draagt.
De aminozuurvolgorde bepaalt de eiwitvorming.
Eiwitsynthese is verdeeld in drie fasen: transcriptie, Vertaling en aminozuur activatie.
meer weten over RNA en DNA.
Transcriptie
In de transcriptiefase transcribeert messenger RNA (mRNA) de boodschap van het cistron (onderdeel van het DNA).
Het RNA-polymerase-enzym bindt aan een enzymcomplex. De dubbele helix wordt ongedaan gemaakt en daarmee worden de waterstofbruggen die de bases van de ketens verbinden vernietigd.
Daarna begint het proces van het synthetiseren van een mRNA-molecuul. Tijdens dit proces ontstaan de verbindingen tussen de bases:
- DNA-adenine met mRNA-uracil.
- DNA-thymine met mRNA-adenine.
- cytosine uit DNA met guanine uit mRNA enzovoort.
Uiteindelijk scheidt het mRNA-molecuul zich van de DNA-streng (die op zijn beurt weer waterstofbruggen heeft) en wordt de dubbele helix hersteld.
Voordat het de kern verlaat, wordt het RNA gerijpt of verwerkt. Sommige delen worden verwijderd en de delen die overblijven, vormen een binding met elkaar en vormen een volwassen RNA.
Dit RNA heeft de codering van aminozuren en kan overgaan naar het cytoplasma, het deel van de cel waar de translatiefase zal plaatsvinden.
Vertaling
In dit stadium worden eiwitten gevormd.
De translatiefase vindt plaats in het cytoplasma van de cel en bestaat uit een proces waarbij de in het mRNA aanwezige boodschap in het ribosoom wordt gedecodeerd.
Activering van aminozuren
Tijdens het vertaalproces komt het Transport RNA (tRNA) in het spel. Het wordt zo genoemd omdat het de functie heeft om aminozuren van het cytoplasma naar de ribosomen te transporteren.
De aminozuren worden vervolgens geactiveerd door bepaalde enzymen die aan het tRNA binden, waardoor het aa-tRNA-complex ontstaat.
Eiwitelektroforese
Eiwitelektroforese is een test die bestaat uit het scheiden van de eiwitten die in de urine (urine-eiwitten) of in bloedserum (serumeiwitten) worden aangetroffen.
Het is een test die wordt gebruikt om de afwezigheid, vermindering of toename van eiwitten te detecteren, naast het detecteren van de aanwezigheid van abnormale eiwitten. Deze test helpt bij de diagnose van ziekten die de opname, het verlies en de productie van eiwitten beïnvloeden.
Een onregelmatige hoeveelheid eiwitten kan wijzen op bijvoorbeeld nierproblemen, diabetes, auto-immuunziekten en kanker.
Het meten van de hoeveelheid totaal eiwit kan ook de voedingsstatus van een persoon aangeven.
Overtollig eiwit in het lichaam
De inname van eiwitten moet matig zijn, omdat te veel ervan kan leiden tot gezondheidsproblemen. Een organisme dat een overmatige hoeveelheid eiwit heeft, kan nierschade oplopen (bijv. stenen) en ziekten ontwikkelen zoals arteriosclerose en osteoporose, gewichtstoename hebben en problemen hebben met: lever.
Om deze reden is het noodzakelijk om zeer voorzichtig te zijn bij het volgen van het zogenaamde "eiwitdieet" (dieet op basis van voedingsmiddelen die goede eiwitbronnen zijn), aangezien de consumptie niet kan worden overdreven.
Laag eiwit in het lichaam
Terwijl een overmatige hoeveelheid eiwit in het lichaam schadelijk is voor het lichaam, is een te lage hoeveelheid ook schadelijk.
Een van de effecten van de lage hoeveelheid eiwit in het lichaam is bijvoorbeeld atrofie van een deel van het centrale zenuwstelsel.
Bovendien kan het individu ook last hebben van gewichtsverlies, constante vermoeidheid, spierpijn, genezingsproblemen, haaruitval, enz.
Curiositeiten
spier eiwitten
De consumptie van eiwitrijke voedingsmiddelen is van fundamenteel belang voor degenen die sporten met de bedoeling spiermassa te krijgen.

Tijdens krachttraining vindt eiwitafbraak plaats in spierweefsel. Om het herstel van deze weefsels te laten plaatsvinden, zoekt het lichaam de bestaande eiwitten uit de voeding.
Om deze reden is het essentieel dat een persoon die traint en bepaalde spiergroei wil bereiken, gedurende de dag regelmatig eiwitrijk voedsel eet.
Sommige mensen nemen hun toevlucht tot het gebruik van eiwitsupplementen om hun aanbevolen dagelijkse hoeveelheid aan te vullen.

Dit gebruik moet echter vergezeld gaan van een specialist in voeding, die zal hebben vertelt de eetgewoonten van de persoon, hun levensstijl en de sport die wordt beoefend, onder andere anderen.
Allergie voor koemelkeiwit
Allergie voor koemelkeiwit, ook wel bekend als APLV, wordt beschouwd als de meest voorkomende voedselallergie. Naar schatting vertoont 2,2% van de kinderen het APLV-beeld in de eerste levensjaren.
Het is een allergische reactie die het organisme niet alleen krijgt wanneer het in contact komt met koemelk, maar ook wanneer het in contact komt met zijn derivaten.

Zie ook wat betekent veganist en wat eet een veganist.
Deze reactie kan zich op drie verschillende manieren manifesteren: IgE gemedieerd, niet-IgE-gemedieerd of gemengd.
Bekijk hieronder enkele kenmerken van elk van de vormen van manifestatie:
| IgE gemedieerd | Niet-IgE-gemedieerd | gemengd |
|---|---|---|
| O organisme produceert antilichamen specifiek IgE (Immunoglubulinen E) om melkeiwitten te bestrijden. | De allergische reactie wordt niet veroorzaakt door de productie van specifieke IgE-antilichamen, maar door de productie van ontstekingscellen. | De allergische reactie wordt veroorzaakt door beide productie van IgE-type antilichamen, evenals door andere cellen in het lichaam. |
| Bij reacties ontstaan onmiddellijk, verschijnen zelfs seconden na contact met melk of melkderivaten. | Bij reacties kunnen uren of dagen verschijnen na contact met koemelk of zijn derivaten. | Bij reacties kunnen direct ontstaan na contact met koemelk of zijn derivaten, of lang daarna. |
| Belangrijkste symptomen: braken, rode plaques die het lichaam jeuken, ademhalingsmoeilijkheden, gezwollen ogen en lippen, diarree en anafylactische shock. | Belangrijkste symptomen: braken, constipatie, diarree (soms met slijm of bloed), krampen en ontstoken darm. | Belangrijkste symptomen: droge huid, met afschilfering (eventueel met wonden), diarree, braken, ontstoken maag en/of slokdarm, buikpijn en reflux. |



