isomerie het is een natuurverschijnsel waarbij verschillende stoffen (qua chemische en fysische eigenschappen) exact dezelfde molecuulformule hebben, zoals in het volgende voorbeeld:
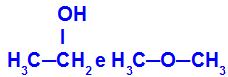
Verschillende stoffen met dezelfde molecuulformule
Ethanol (links) heeft de molecuulformule C2H6O, dat ook voorkomt bij methoxyethaan (rechts), het zijn dus isomeren.
Soorten isomerie
→ platte isomeer
Het is het type isomerie dat de structurele verschillen tussen isomeren bestudeert.
De) Bezetting
Het is het type platte isomerie waarbij het verschil tussen stoffen gebaseerd is op het verschil tussen de organische functies waartoe ze behoren. Zie enkele voorbeelden:
Propanon en propaan:
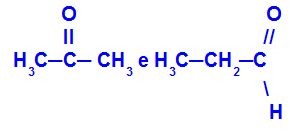
Isomeren die tot verschillende functies behoren
Propanon (links) behoort tot de ketongroep en propanal (rechts) behoort tot de aldehydegroep.
B) Gevangenis
Het is het type platte isomerie waarbij het verschil tussen stoffen is gebaseerd op het verschil tussen de ketens die ze presenteren. Zie een voorbeeld:
2-methylpropaan en butaan
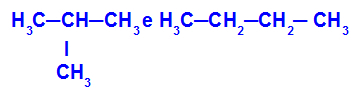
Isomeren met ketens met verschillende classificaties
In het voorbeeld zien we dat 2-methylpropaan (links) een vertakte keten heeft en butaan (rechts) een normale keten.
ç) Positie
Het is het type platte isomerie waarbij het verschil tussen stoffen gebaseerd is op het verschil in positie van een component in hun ketens. Zie een voorbeeld:
1-chloorpropaan en 2-chloorpropaan
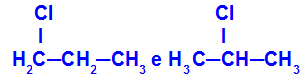
Isomeren met componenten op verschillende posities in de keten
In het voorbeeld kunnen we zien dat 1-chloorpropaan (links) het chloor op koolstof 1 heeft en 2-chloorpropaan (rechts) het chloor op koolstof 2 heeft.
d) Metameria of compensatie
OPMERKING: Isomerie uitsluitend geldig voor heterogene strings.
Het is het type platte isomerie waarbij het verschil tussen de stoffen is gebaseerd op het verschil in positie van een heteroatoom dat aanwezig is in hun ketens. Zie een voorbeeld:
Voorbeeld: Methoxypropaan en ethoxyethaan
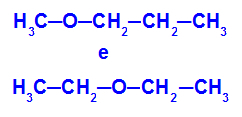
Isomeren met heteroatomen op verschillende posities in de keten
In het voorbeeld kunnen we zien dat zuurstof in methoxypropaan (links) een radicaal heeft met één koolstof aan de ene kant en drie koolstofatomen aan de andere. In ethoxyethaan (rechts) heeft zuurstof een radicaal met aan de ene kant twee koolstofatomen en aan de andere kant twee koolstofatomen.
en)Automatisering
Het is een bijzonder geval van isomerie met een vlakke functie en komt voor in slechts drie organische functies:
Aldehyde
keton
Enol
Dit type isomerie werkt op het feit dat er een chemisch evenwicht is tussen een enol en een aldehyde en tussen een enol en een keton, dat wil zeggen dat deze componenten constant in elkaar worden omgezet. Zie een voorbeeld:
Prop-2-en-1-ol en propanon
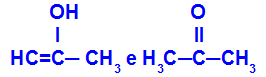
Isomeren die tot verschillende functies behoren
In het voorbeeld kunnen we zien dat Prop-2-en-1-ol (links) tot de groep van enolen behoort, en propanon (rechts) tot de groep ketonen, dus het zijn isomeren van tautomerie.
→ Ruimte-isomerisme
Het is een type isomerie gedefinieerd door de ruimtelijke analyse van het molecuul.
a) Geometrische isomeren
Niet stoppen nu... Er is meer na de reclame ;)
Het is een soort ruimtelijke isomerie die optreedt wanneer de stof moleculen heeft met de volgende kenmerken:
Gesloten keten met twee koolstofatomen met twee verschillende liganden, zoals in het onderstaande voorbeeld:

Gesloten structuur met geometrische isomerie
Open keten met een dubbele binding tussen koolstofatomen en in elk van deze koolstoffen van de dubbele binding zijn er twee verschillende liganden, zoals in het onderstaande voorbeeld:
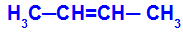
Open structuur met geometrische isomerie
Geometrische isomerie is verdeeld in twee groepen:
1O Groep: cis-trans
Het treedt op wanneer de twee liganden van het ene koolstofatoom strikt gelijk zijn aan de twee liganden van het andere koolstofatoom, zowel in de open structuur als in de gesloten structuur.
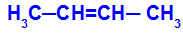
Keten van een stof met cis-trans-isomerie
Het isomeer wordt cis genoemd als dezelfde liganden zich in hetzelfde vlak bevinden.

Voorbeeld van een cis-isomeer
Het isomeer wordt trans genoemd als de verschillende liganden zich in hetzelfde vlak bevinden.

Voorbeeld van een trans-isomeer
2O Groep: E-Z
Het treedt op wanneer de twee liganden van één koolstof verschillend zijn in relatie tot de twee liganden van de andere koolstof, hetzij in de open structuur of in de gesloten structuur.

Keten van een stof die E-Z isomerie heeft
Het isomeer wordt E genoemd als de liganden met het hoogste atoomnummer zich in tegenovergestelde vlakken bevinden. In het onderstaande voorbeeld heeft de koolstof aan de linkerkant de Br met het hoogste atoomnummer (35) en in de andere is er zuurstof (8).
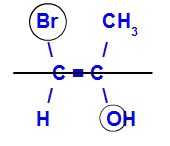
Voorbeeld van een E-isomeer
Het isomeer wordt Z genoemd als de liganden met het hoogste atoomnummer in hetzelfde vlak liggen. In het onderstaande voorbeeld heeft de koolstof aan de linkerkant de Br met het hoogste atoomnummer (35) en in de andere is er zuurstof (8).

Voorbeeld van een Z-isomeer
B) optische isomeer
Het is een vorm van ruimtelijke isomerie die alleen optreedt als de stof moleculen heeft met chirale koolstof (degene die vier verschillende liganden heeft) in hun structuren. Het molecuul met chirale koolstof heeft het vermogen om licht als volgt te polariseren en af te buigen:
Naar rechts (rechter isomeer)
Naar links (linksdraaiende isomeer)
Een verbinding met optische activiteit heeft altijd: actieve isomeren (optische antipoden genoemd) en inactieve isomeren (mengsel tussen twee actieve isomeren, een mengsel dat racemisch wordt genoemd).
We kunnen de volgende formule gebruiken om het aantal actieve (IOA) en inactieve (IOI) isomeren te bepalen van een verbinding met chirale koolstof:
IOA = 2Nee
IOI = 2Nee
2
Hieronder is een voorbeeld van een verbinding met geometrische isomerie:
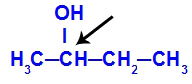
Chirale koolstof in butaan-2-ol
De structuur van butaan-2-ol heeft de volgende liganden:
Methyl (CH3)
Ethyl (CH3-CH2)
Waterstof (H)
Hydroxyl (OH)
Omdat het maar één chiraal koolstofatoom heeft, heeft butaan-2-ol:
Actieve isomeren:
IOA = 21
IOA = 2
Inactieve isomeren:
IOI = 21
2
IOI = 2
2
IOI = 1
Door mij Diogo Lopes Dias
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
DAGEN, Diogo Lopes. "Wat is isomerie?"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria.htm. Betreden op 27 juni 2021.