Bij covalente bindingen, ook wel genoemd moleculaire of homopolaire bindingen, zijn die voorkomen tussen atomen van elektronegatieve elementen, dat wil zeggen, met de neiging om elektronen te ontvangen, een binding van tot stand brengend elektronen uit hun valentieschillen delen.
Covalente binding kan optreden tussen de volgende elementen: waterstof, niet-metalen en halfmetalen. Metalen nemen nooit deel aan dit type binding.
Laten we een eenvoudig voorbeeld van een covalente binding bekijken: de waterstofgasvormende binding (H2):
H + H → H2
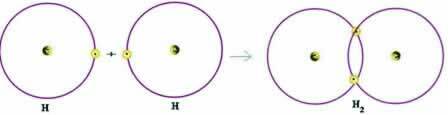
Merk op dat beide atomen een elektron moesten ontvangen om hun valentieschil te voltooien - volgens de Octet-regel - en op deze manier stabiel te blijven. Daarom deelden ze hun elektronen en op deze manier hadden ze allebei twee elektronen, hadden ze hun volledige K-schil en verkregen ze de configuratie van het edelgas helium.
Dit delen van elektronen is wat dit type binding onderscheidt van ionische binding, waarbij elektronenoverdracht plaatsvindt.
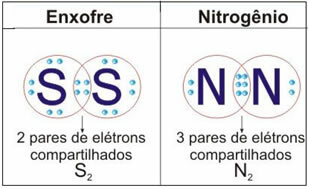
Zie onderstaande afbeelding voor nog twee voorbeelden van deze casus:
Niet stoppen nu... Er is meer na de reclame ;)
In dit type binding is er de vorming van moleculen, die kunnen worden weergegeven door hun respectieve molecuulformules, dat wil zeggen, de eenvoudigste weergave die aangeeft hoeveel atomen van elk element er in het molecuul zijn. Enkele voorbeelden van molecuulformules zijn: H2, S2, O2, Nee2, H2O, CO2, enz.
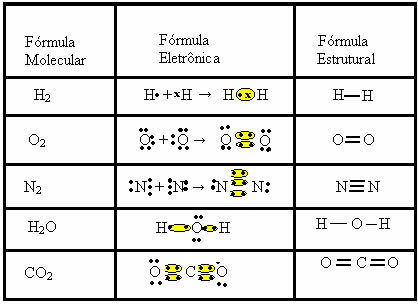
De covalente binding kan worden weergegeven door twee andere formules:
- Elektronische formule of Lewis-formule: in deze formule verschijnen ook de elektronen van de valentieschil van elk atoom en de vorming van elektronische paren. Deze elektronen worden gesymboliseerd door de tekens . of x;
- Platte structuurformule of Couper structuurformule: toont de links van de elementen, waarbij elk gedeeld paar overeenkomt met een streepje. Als het slechts een streepje is, noemen we het een enkele link; als er twee zijn, dubbele binding; en als er drie streepjes zijn, drievoudige binding.
Kijk naar andere voorbeelden van covalente bindingen die worden weergegeven door deze drie chemische formules:
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
FOGAÇA, Jennifer Rocha Vargas. "Covalente obligaties"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/ligacoes-covalentes.htm. Betreden op 27 juni 2021.


