Koolstof is een chemisch element met een atoomnummer (Z) gelijk aan 6, wat betekent dat de atomen die het vormen zes protonen in hun kern hebben. De molaire massa is 12.011 g/mol en er worden in de natuur drie isotopen van koolstof gevonden, namelijk: o koolstof-12, koolstof-13 en koolstof-14. C-12 heeft zes protonen en zes neutronen in de kern en is de meest voorkomende.
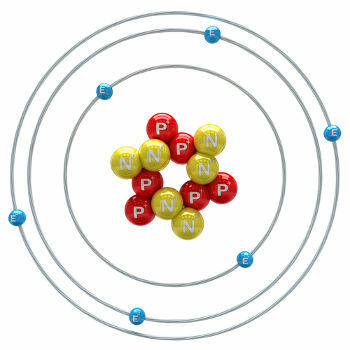
koolstofatoom-12 illustratie
C-13 heeft zeven neutronen en is de minst voorkomende (1,01 tot 1,14%). De C-14 heeft acht neutronen en is a radioactief element die β-deeltjes (elektronen) uitzendt, die in de stratosfeer van de aarde worden gevormd wanneer neutronen van kosmische straling de stikstof-14 in deze bovenste lagen van de atmosfeer bombarderen. Het wordt door alle planten en dieren opgenomen en, wetende dat de halfwaardetijd ongeveer 5730 jaar is, wordt het gebruikt om de leeftijd van fossielen tussen 100 en 40.000 jaar te bepalen. Meer details over C-14 en de dateringstechniek zijn te zien in de tekst. Wat is koolstof-14?
Koolstof is vierwaardig, dat wil zeggen, het heeft nog vier protonen nodig in zijn valentielaag (buitenste laag) om de octetregel te gehoorzamen. Daarom maakt het gewoonlijk vier covalente bindingen, waarbij het vier elektronenparen deelt met andere elementen en met andere koolstoffen. Deze bindingen kunnen enkelvoudig, dubbel of drievoudig zijn en resulteren in de vorming van miljoenen verschillende verbindingen. Om deze reden is een gebied van Chemie gecreëerd, de Organische chemie, die de belangrijkste verbindingen bestudeert die zijn afgeleid van koolstof, met uitzondering van enkele gevallen die van minerale oorsprong zijn, zoals: kooldioxide (CO2), O koolmonoxide (CO), O calciumcarbonaat (CaCO3), natriumwaterstofcarbonaat of natriumbicarbonaat (NaHCO3), tussen anderen. Deze verbindingen worden bestudeerd in Anorganische scheikunde.
Koolstof voert allotropie uit en vormt eenvoudige stoffen, dat wil zeggen stoffen die alleen worden gevormd door bindingen tussen koolstofatomen. Er zijn ten minste zeven allotropen van koolstof, namelijk grafiet (alfa en bèta), diamant, lonsdaleiet (zeshoekige diamant), chaoiet, koolstof (VI) en fullerenen. Er zijn eigenlijk verschillende soorten fullerenen, die synthetische allotrope vormen van koolstof zijn. Ze hebben een veelvlakkige structuur met een koolstofatoom op elk hoekpunt en een voorbeeld is de Ç60 genaamd buckminsterfullereen, en de structuur lijkt op een voetbal.
Niet stoppen nu... Er is meer na de reclame ;)
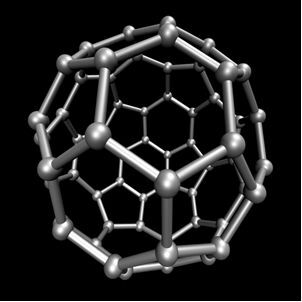
Koolstof-60 (buckminsterfullereen)
Onder deze allotropen van koolstof zijn er echter maar twee die natuurlijk zijn. grafietHet is van Diamant. Ze verschillen alleen door de kristallijne rangschikking van atomen in de ruimte, zoals weergegeven in de onderstaande figuur, en dit resulteert in totaal verschillende fysisch-chemische eigenschappen. Lees de tekst koolstof allotropie voor meer informatie.

De twee natuurlijke allotrope vormen van koolstof zijn grafiet en diamant.
Een andere synthetische allotrope vorm van koolstof is de nanobuisjes (afbeelding hieronder) die brede biologische toepassingen hebben, waaronder medische diagnostiek en behandelingen.

Illustratie van een microscopisch koolstofnanobuisje
Dus, koolstof is aanwezig in alles om ons heen en in ons, omdat hij componeert natuurlijke organische verbindingen — zoals fossiele brandstoffen, waaronder olie, steenkool en aardgas, en andere brandstoffen zoals ethanol en biobrandstoffen, onder meer landbouwproducten. vorm ook synthetische organische verbindingen, zoals synthetische vezels waaruit stoffen bestaan, medicijnen, polymeren waaruit kunststoffen en rubbers bestaan, insecticiden, kleurstoffen en nog veel meer. In ons, dieren en groenten, vormt koolstof zeer belangrijke verbindingen, zoals koolhydraten, zoals suiker, glucose en cellulose; de eiwitten die bijvoorbeeld DNA vormen en samen met lipiden de membranen van rode bloedcellen en witte bloedcellen.
Dit alles toont het belang aan van koolstof voor het in stand houden van het leven. Maar het is ook in verband gebracht met negatieve aspecten, zoals de intensivering van broeikaseffect en de consequentie opwarming van de aarde, dit komt omdat de belangrijkste boosdoener van deze problemen de koolstofdioxideverbinding (CO2). Voornamelijk door de grote verbranding van fossiele brandstoffen waarbij dit gas vrijkomt, is de concentratie CO2 in de atmosfeer is toegenomen. Als broeikasgas veroorzaakt het de genoemde problemen. Aan de andere kant is koolstofdioxide ook aanwezig in vitale reacties zoals fotosynthese en ademhaling.
Door Jennifer Fogaça
Afgestudeerd in scheikunde

