U nitroverbindingen worden gekenmerkt door de aanwezigheid van de volgende functionele groep:
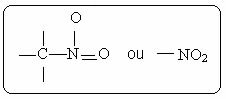
Van zijn derivaten is nitrobenzeen de bekendste, een gele vloeistof, giftig, onoplosbaar in water, compact en gebruikt als oplosmiddel voor organische stoffen.
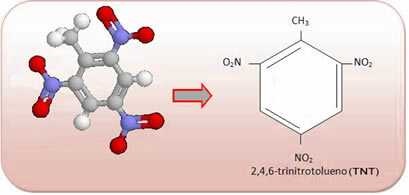
Deze verbindingen zijn zeer reactief, dus ze worden veel gebruikt als explosieven. Enkele bekende voorbeelden zijn 2-methyl-1,3,5 - trinitrobenzeen of 2,4,6-trinitrotolueen (TNT), of 2,4,6 - dinitrotolueen (DNG) en trinitroglycerine (TNG), dat behalve explosief ook wordt gebruikt als coronaire vasodilatator bij risico op infarct.
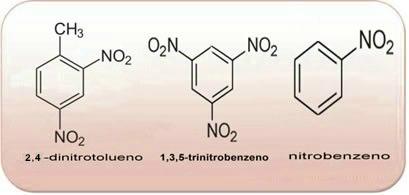
Bovenstaande verbindingen zijn allemaal aromatisch, hoe groter de hoeveelheid NO2 in zijn moleculen, hoe explosiever het zal zijn. Hun bereidingen en eigenschappen verschillen sterk van die van alifatische nitroverbindingen. Nitroalkanen zijn kleurloze, polaire vloeistoffen, ook onoplosbaar in water en gebruikt in organische syntheses, als tussenproducten en als oplosmiddelen.
Niet stoppen nu... Er is meer na de reclame ;)
De nomenclatuur van nitroverbindingen volgt de onderstaande regel, vastgesteld door de International Union of Pure and Applied Chemistry (IUPAC):

We hebben dus de volgende namen voor de onderstaande nitrocompound-structuren:
H3Ç__BIJ DE2: nitromethaan
H3Ç__CH2__BIJ DE2: nitroethaan
H3Ç__CH2__ CH2__BIJ DE2: 1- nitropropaan
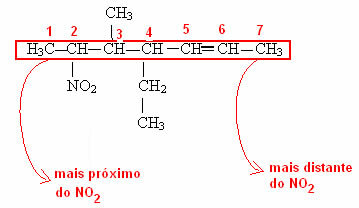
Merk op dat in het laatste voorbeeld het nodig was om te nummeren waar de functionele groep van de koolstofketen vandaan komt. Deze nummering wordt altijd gedaan vanaf het dichtstbijzijnde uiteinde van de functionele groep. Bekijk in het onderstaande voorbeeld hoe dit wordt gedaan:
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
FOGAÇA, Jennifer Rocha Vargas. "Nitroverbindingen"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/nitrocompostos.htm. Betreden op 27 juni 2021.