Balansthermisch is de toestand waarin een lichaam zich in de dezelfdetemperatuur- dan hun omgeving. Het is waargenomen dat alle lichamen die een hogere temperatuur hebben dan hun buren de neiging hebben om ze spontaan warmte te geven totdat beide dezelfde temperatuur beginnen te vertonen.
Kijkenook:Grondbeginselen van thermologie
Thermisch evenwicht en de nulwet van de thermodynamica
Thermisch evenwicht is het centrale concept achter de nulwet van de thermodynamica. Een dergelijke wet stelt vast dat, in het geval waar twee thermodynamische systemen, DE en B, zijn in thermisch evenwicht met een derde thermodynamisch systeem, Ç, dan, DE en B ze zullen ook in thermisch evenwicht zijn.
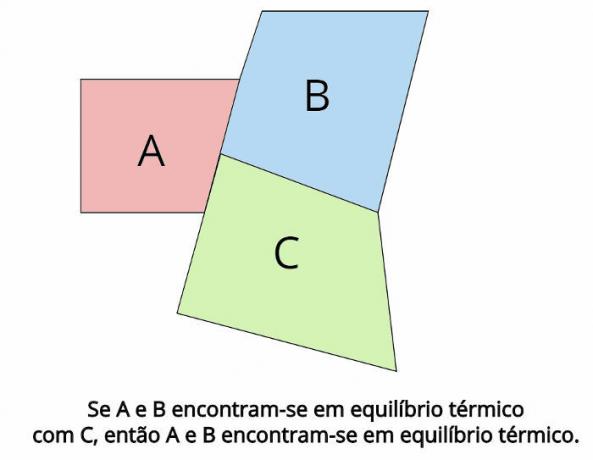
In thermisch evenwicht moeten de eindtemperaturen van elk lichaam gelijk zijn: TDE = TB = TÇ
Bekijk wat de verklaring van de nulwet van de thermodynamica vaststelt:
“Als twee lichamen in thermisch evenwicht zijn met een derde lichaam, dan zijn die lichamen in thermisch evenwicht met elkaar.”
Een andere manier om thermische balans te begrijpen is gebaseerd op de interne energie van lichamen. Interne energie, of gewoon thermische energie, is een fysieke grootheid
directproportioneel à temperatuur- van het lichaam. Daarom, als er lichamen zijn met verschillende temperaturen binnen hetzelfde thermodynamische systeem, zullen ze verschillende modules hebben van interne energie en zal daarom een deel van die energie tussen hen overbrengen totdat er geen verschil is tussen hun energieën. intern. Wil je meer weten over wat interne energie is en wat de eigenschappen ervan zijn? Toegang tot het artikel: Interne energie.warmte en thermische balans
Warmteoverdracht vindt altijd spontaan plaats, van het lichaam met de hoogste temperatuur naar het lichaam met de laagste temperatuur. Deze overdracht van energie in de vorm van warmte kan plaatsvinden door processen zoals: het rijden, convectie en straling.
Het rijden: Het is de overdracht van warmte tussen lichamen die vooral optreedt in vaste stoffen. Bij dit type geleiding vinden geen massaoverdrachten plaats. Deze vorm van warmteoverdracht verklaart hoe thermisch evenwicht ontstaat in bijvoorbeeld metalen.
Convectie: Het is een warmteoverdracht die plaatsvindt in vloeistoffen. Bij deze manier van warmteoverdracht is er massaoverdracht, terwijl het verwarmde fluïdum beweegt en convectiestromen vormt totdat al het fluïdum een thermisch evenwicht bereikt.
Straling: Het is de overdracht van warmte door elektromagnetische golven, dus dit proces vindt plaats zelfs als er geen fysiek medium is tussen het lichaam en een ander lichaam bij verschillende temperaturen. De warmte die wordt overgedragen, is in dit geval het equivalent van elektromagnetische golven met minder energie dan zichtbaar licht, dus warmtestraling, gelegen in het gebied van de of infrarood.
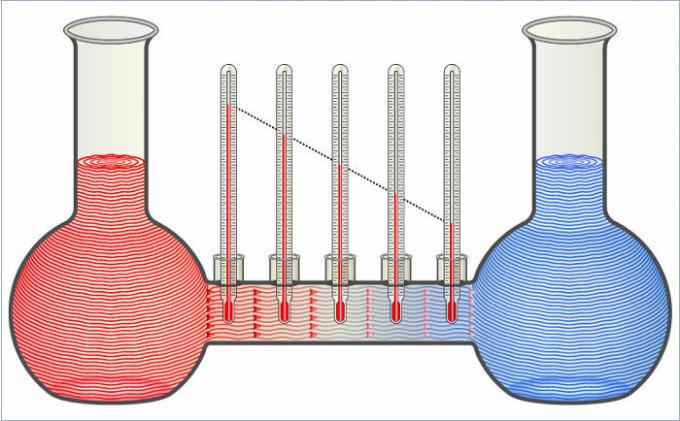
De twee vloeistoffen in de figuur dragen warmte aan elkaar over totdat hun temperatuur gelijk is.
Wilt u meer weten over hoe elk van de warmteoverdrachtsprocessen verloopt? Toegang tot het artikel: Warmtevoortplantingsprocessen.
voelbare warmte
wanneer er is verschilintemperatuur- tussen twee lichamen, of tussen een lichaam en zijn omgeving, zal er spontaan warmte-uitwisseling tussen hen plaatsvinden, zodat de Het lichaam met een hogere temperatuur koelt af en het lichaam met een lagere temperatuur warmt op totdat ze allemaal de temperatuur hebben bereikt in balansthermisch.
De hoeveelheid warmte die wordt uitgewisseld tussen lichamen bij verschillende temperaturen heet voelbare warmte en dit bedrag kan worden berekend met de formule in de onderstaande figuur:
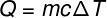
Vraag – warmte (limoen of J)
m – massa (g of kg)
ç - soortelijke warmte (cal/gºC of J/kg. K)
T – temperatuurvariatie (°C of K)
In de bovenstaande formule is het belangrijk om de grootsheid van de naam te benadrukken specifieke hitte. een dergelijke omvang meet de hoeveelheid energie per massa die een stof moet leveren of absorberen om de temperatuur met 1°C te laten variëren. In het geval van bijvoorbeeld zuiver water, en onder normale drukomstandigheden, is om de temperatuur met 1 C te variëren, 1,0 calorie nodig voor elke gram water.
Dus alle stoffen die thermisch contact met elkaar hebben gemaakt, hebben de neiging om de toestand te bereiken van: balansthermisch na verloop van tijd spontaan, maar sommige vereisen een grotere hoeveelheid energie om dit te doen en dit heeft direct invloed op de temperatuur om thermisch evenwicht te bereiken.
lezenook:Wat is temperatuur?
latente warmte
Het is mogelijk dat een lichaam tijdens warmte-uitwisseling met zijn omgeving druk, temperatuur en volume vertoont waardoor het een verandering in zijn fysieke toestand ondergaat. Deze veranderingen vinden plaats in temperatuur-constante (voor lichamen samengesteld uit een enkele stof, zonder onzuiverheden), dat wil zeggen, ondanks het ontvangen of geven van warmte aan de externe omgeving, verandert de temperatuur van deze lichamen niet.
Dit is alleen mogelijk omdat alle uitgewisselde energie, in dit geval, wordt gebruikt om de conformatie van je moleculen te veranderen. Vanaf het moment dat de energiebarrière is "overwonnen" en alle inhoud van het lichaam zich in een andere fysieke staat bevindt, Het lichaam blijft warmte uitwisselen met zijn omgeving, tenzij de temperatuur natuurlijk gelijk is aan de buitentemperatuur.
O latente warmte kan worden berekend met de formule in de onderstaande afbeelding, bekijk het eens:
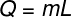
Vraag – latente warmte (limoen of J)
m – massa (g of kg)
L – specifieke latente warmte (cal/g of J/kg)
Thermische evenwichtsformule
Voor het geval we willen weten wat de temperatuur-inbalans van een thermodynamisch systeem, is het noodzakelijk dat we het betreffende systeem beschouwen als een systeemgeïsoleerd, dat wil zeggen, we moeten aannemen dat er geen hoeveelheid warmte wordt uitgewisseld met de wijken van dit systeem.
Uit deze toestand kunnen we zeggen dat de volledige hoeveelheid uitgewisselde warmte alleen wordt uitgewisseld tussen de lichamen die deel uitmaken van dit systeem, zonder rekening te houden met warmteverliezen bijvoorbeeld voor de wanden van de container. In dit geval zeggen we dat de container heeft thermische capaciteit: verwaarloosbaar, dwz het neemt geen warmte op.
Stel je de volgende situatie voor: in een kop hete thee, met een verwaarloosbare warmtecapaciteit, giet je wat ijsblokjes. Om de thermische evenwichtstemperatuur te bepalen, moeten we niet alleen de beginvoorwaarden van het systeem kennen, maar ook enkele overwegingen maken:
Alle warmte die de hete thee aan het ijs geeft, wordt er volledig door geabsorbeerd, aangezien de kop een verwaarloosbare warmtecapaciteit heeft.
We moeten geen rekening houden met warmteverliezen naar de lucht en elke andere omgeving, zodat dit kopje thee kan worden begrepen als een gesloten thermodynamisch systeem.
Op deze manier kunnen we vaststellen dat de volledige hoeveelheid warmte die door het ijs werd ontvangen, werd opgegeven door de hete thee, en daarmee schreven we onze formule voor het berekenen van de thermische balans:
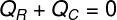
VraagR – Warmte ontvangen
VraagÇ – warmte afgegeven
De warmte gegeven in (QÇ), verwijst naar de hoeveelheid warmte die de hete thee heeft overgedragen aan de ijsblokjes die erin zijn geplaatst. Reeds ontvangen warmte (QR) is de hoeveelheid warmte die deze ijsblokjes hebben ontvangen. Deze hoeveelheid warmte heeft twee eigenschappen: warmte gevoelig en heet latent, omdat, om in thermisch evenwicht te komen, de ijsblokjes waarschijnlijk zullen smelten.
Bepaling van de thermische evenwichtstemperatuur
Laten we de thermische evenwichtstemperatuur bepalen uit de volgende situatie:
Een kopje met een verwaarloosbare thermische capaciteit, die 200 ml (200 g) thee bevat bij een begintemperatuur van 70 ° C, krijgt 10 g ijs bij een temperatuur van -10 ° C. Bepaal de thermische evenwichtstemperatuur van het systeem (neem aan dat de soortelijke warmte van thee gelijk is aan de soortelijke warmte van water):
Gegevens:
çWATER = 1,0 cal/g°C
çIJS = 0,5 cal/g°C
LIJS = 80 cal/g
Ten eerste zijn we van mening dat alle warmte die door het ijs werd ontvangen, door de thee werd weggegeven:

Vervolgens moet worden aangegeven welke vormen van warmte zijn gegeven en ontvangen:
Thee: De thee gaf alleen voelbare warmte (Qzo), aangezien zijn fysieke toestand niet is veranderd.
Ijs: Het ijs was aanvankelijk op -10°C, dus het kreeg voelbare warmte (Qzo) tot een temperatuur van 0 ºC, daarna latente warmte ontvangen (QL) vloeibaar te maken. Nadat het vloeibaar was geworden, ontving het latente warmte (Qzo) totdat het in thermisch evenwicht komt (TF) met thee.
Als we vertalen wat hierboven is geanalyseerd in de vorm van een vergelijking, moeten we de volgende berekening oplossen:
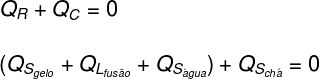
Door de gegevens van de oefening in de bovenstaande vergelijking te vervangen, moeten we de volgende berekening oplossen:
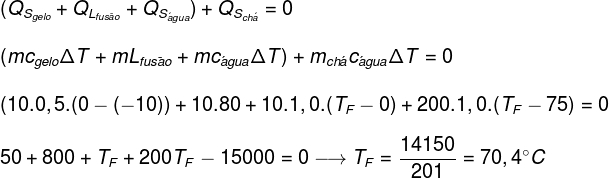
Volgens bovenstaande berekening zou de evenwichtstemperatuur van het thee+ijssysteem ongeveer 70,4°C moeten zijn.
Experiment met thermische balans
Om de thermische balans tussen twee lichamen te testen, kunnen we verschillende experimenten uitvoeren. De eenvoudigste hiervan is echter het gebruik van a calorimeter het is een thermometer. De calorimeter is een adiabatische container (die geen warmte doorlaat), met thermische capaciteit oververwaarloosbaar, zoals een pot bekleed met piepschuim, bijvoorbeeld, dat een goede thermische isolator is.

De calorimeter wordt gebruikt om de temperatuurvariatie van het systeem binnenin te meten.
Thermische balans en leven op aarde
O balansthermisch het speelt een fundamentele rol in het aardse leven. Zonder de aanwezigheid van broeikasgassen in de atmosfeer van de aarde, zijn de meeste thermische straling van de planeet zou het verlaten en zich voortplanten in de ruimte. Na verloop van tijd zou dit enorme afkoeling over de hele planeet veroorzaken, waardoor de oceanen na verloop van tijd zouden bevriezen.
Daarnaast spelen de oceanen een sleutelrol in balansthermisch van de planeet. Op grond van zijn geweldige pasta en warmtespecifiek, de oceanen zijn begiftigd met een enorme capaciteitthermisch, dat wil zeggen, ze moeten enorme hoeveelheden warmte ontvangen om hun temperatuur te veranderen. Om deze reden zijn ze in staat om de temperatuur van de planeet zeer efficiënt te regelen. Regio's ver van de oceanen en met weinig water hebben vaak grote thermische bereiken, zoals in het geval van woestijnen, die overdag extreem heet zijn en 's nachts ijskoud.
Daarom, de balansthermisch het is een proces van fundamenteel belang voor het in stand houden van fysieke, chemische en biologische processen op de planeet en daarom essentieel voor het bestaan van leven op aarde.
Door mij Rafael Helerbrock
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/equilibrio-termico.htm

