Elke cel is een apparaat waarin een spontane oxidatie-reductiereactie plaatsvindt, die een elektrische stroom genereert, die op zijn beurt wordt gebruikt om bepaalde apparatuur te laten werken.
Deze apparaten hebben hun naam gekregen omdat de eerste batterij die werd gemaakt, werd uitgevonden door Alessandro Terug in het jaar 1800, en werd gevormd door zink en koperen schijven gescheiden door katoen gedrenkt in pekel. Deze set werd afwisselend op elkaar geplaatst, opstapelen de schijven en vormen een grote kolom. Hoe was het accu van schijven, begon met die naam te worden genoemd.

De batterijen bestaan altijd uit twee elektroden en een elektrolyt. De positieve elektrode heet a kathode en dit is waar de reactie van vermindering. De negatieve elektrode is de anode en dit is waar de reactie van oxidatie. Elektrolyt wordt ook wel zoutbrug en is de ionengeleidende oplossing.
Om te begrijpen hoe dit elektrische stroom genereert, zie het geval van een van de eerste batterijen, de, De stapel van Daniell
, waarin zich een container bevond met een oplossing van kopersulfaat (CuSO4(aq)) en, ondergedompeld in die oplossing, was een koperen plaat. In een andere aparte container zat een oplossing van zinksulfaat (ZnSO4(aq)) en een ondergedompelde zinken plaat. De twee oplossingen waren verbonden door een zoutbrug, een glazen buis met een kaliumsulfaatoplossing (K2ENKEL EN ALLEEN4(aq)) met glaswol aan de uiteinden. Ten slotte waren de twee platen met elkaar verbonden door een extern circuit, met een lamp, waarvan de verlichting de doorgang van elektrische stroom zou aangeven: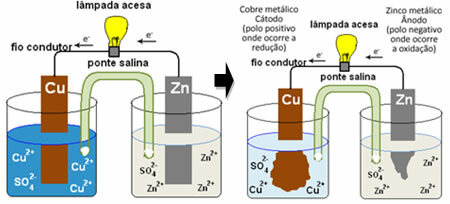
Wat er gebeurt, is dat zink een grotere neiging heeft om te oxideren, dat wil zeggen om elektronen te verliezen, dus het metallische zink van het blad werkt als de negatieve elektrode, de anode, waar oxidatie plaatsvindt: Zn(en) Zn2+(hier) + 2 en-. De elektronen die door het zink verloren gaan, worden door het externe circuit naar het koper getransporteerd, waardoor de elektrische stroom wordt opgewekt die de lamp aanzet. De koperionen in de oplossing ontvangen elektronen (reduceren) en transformeren in metallisch koper dat op de koperplaat wordt afgezet. Dit betekent dat dit de positieve elektrode, kathode, is waar de reductie optreedt: kont2+(hier) + 2 en- kont(en).
Niet stoppen nu... Er is meer na de reclame ;)
De batterijen van vandaag hebben hetzelfde werkingsprincipe, waarbij het ene metaal elektronen aan het andere afstaat, via een geleidende oplossing, en een elektrische stroom wordt geproduceerd. Het verschil is dat de batterijen die tegenwoordig worden gebruikt, droog zijn, omdat ze geen vloeibare oplossing als elektrolyt gebruiken, zoals bij Daniell's batterij.
Tegenwoordig is er een zeer grote verscheidenheid aan batterijen die commercieel worden verkocht. Onder hen zijn de meest voorkomende de zure cellen (van Leclanché) en dealkaline batterijen.
Beide hebben zink als negatieve elektrode; aan de andere kant is er als positieve pool een grafietstaaf geïnstalleerd in het midden van de stapel omringd door mangaandioxide (MnO2), houtskoolpoeder (C) en een natte pasta. Het verschil is dat in de zuurhoop ammoniumchloride (NH) wordt gebruikt in de natte pasta.4Cl) en zinkchloride (ZnCl2) - zouten met een zuur karakter - naast water (H2O). In de alkalinebatterij wordt kaliumhydroxide (KOH), een base, gebruikt.

Leclanché-batterijen zijn het meest geschikt voor apparatuur die licht en continue ontlading vereist, zoals afstandsbediening, wandklok, draagbare radio en speelgoed. Alkalinebatterijen daarentegen hebben 50 tot 100% meer energie dan een gewone batterij van hetzelfde formaat, wat wordt aanbevolen voor apparatuur die vereisen snellere en intensievere downloads zoals radio's, cd/dvd-spelers, draagbare mp3's, zaklampen, digitale fotocamera's enz.

Lees meer over welke elektrolyten en elektroden ook in deze en andere soorten batterijen worden gebruikt. wat betreft welke soorten apparatuur ze het meest worden aanbevolen, lees de gerelateerde artikelen meer balg.
Door Jennifer Fogaça
Afgestudeerd in scheikunde