Gallium is een chemisch element met een atoomnummer (Z) gelijk aan 31 en het symbool is Ga. Het behoort tot familie 13 (of groep IIIA, volgens de oude nummering), de familie van borium, zijnde een "zilver" gekleurd metaal vergelijkbaar met aluminium.
Een van de meest interessante eigenschappen is het smeltpunt, dat laag is vergeleken met bijna alle metalen (behalve kwik) die eerder bekend waren, ongeveer 29,76°C. Onder omgevingsomstandigheden is het dus gewoonlijk in vaste toestand. Op warmere dagen smelt het echter in een vloeibare toestand. Dat is waarom, als we dit metaal in onze handen houden, het begint te smelten, omdat onze temperatuur hoger is dan het smeltpunt.

Bij het opslaan van gallium kan het niet de hele container vullen omdat het uitzet terwijl het stolt
Er zijn veel video's op internet die een lepel laten zien die smelt als hij in een glas water wordt geplaatst. In feite zijn deze lepels gemaakt van gallium, niet van andere, meer gebruikelijke metalen of metaallegeringen zoals aluminium of
staal. Dus wanneer de galliumlepel in warm water wordt geplaatst, wordt deze vloeibaar. Zie meer hierover in de tekst “Voorstel voor een experimentele les over smeltpunt”.Gallium heeft ook nog een ander kenmerk, namelijk het enorme bereik tussen smelt- en kooktemperaturen. Zoals eerder vermeld, ligt het smeltpunt rond 29,76°C, maar het kookpunt ligt rond de 2204°C.
Gallium werd op 27 augustus 1875 tussen 03.00 uur en 04.00 uur ontdekt door de Franse chemicus Paul Lecoq de Boisbaudran. Een interessant aspect is dat jaren eerder, in 1868, de Russische chemicus Dimitri Ivanovitch Mendeleyev (1834-1907) stelde het periodiek systeem voor, maar liet een gat open voor een element dat tot dan toe was onbekend. Mendeleyev noemde het eka-aluminium, omdat hij op spectaculaire wijze voorspelde dat in de horizontale rij boor, tussen aluminium en uranium, dit element zou liggen.
Niet stoppen nu... Er is meer na de reclame ;)

Franse chemicus Paul Lecoq de Boisbaudran - ontdekker van gallium
Mendeleyev voorspelde zelfs de eigenschappen van dit element, zoals het atoomgewicht, dat 68 zou zijn, en het soortelijk gewicht, dat 5,9 zou zijn. Zo ontdekte Lecoq een element met een atoomgewicht van 69 en een soortelijk gewicht van 4,7, wat aangeeft dat Mendeleyev het bij het verkeerde eind had. Mendeleyev zei echter dat het monster van Lecoq niet zuiver genoeg was en dat hij de experimenten moest herhalen.
Dat is wat Lecoq deed, en verrassend genoeg had Mendeleyev gelijk, het soortelijk gewicht van dit nieuwe element was 5,9. Het was dus echt het eka-aluminium dat Mendeleyev voor ogen had.
Lecoq gaf de naam "Gallium" aan het ontdekte element in verwijzing naar de Latijnse naam voor Frankrijk, namelijk Gallia. Maar er zijn sommigen die zeggen dat hun doel in feite anders was, want in het Frans betekent Le coq "de haan" en in het Latijn is het gallus.
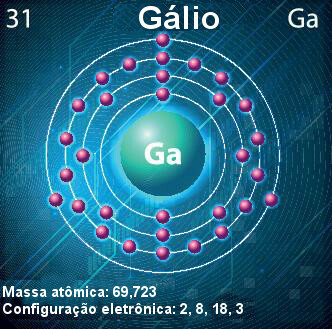
Galliumatoom — symbool, atoomnummer, atoommassa en elektronenconfiguratie
Een andere eigenschap van gallium is dat het andere metalen aantast. Op internet zijn enkele video's te vinden die de plaatsing van een beetje vloeibaar gallium op een aluminium blikje laten zien. Na een paar uur is het mogelijk om het heel gemakkelijk met je handen te breken.
Onder de toepassingen van gallium kunnen we het volgende benadrukken:
* Het wordt gebruikt bij de vervaardiging van spiegels;
* Het is een halfgeleider en geleidt twee keer zoveel warmte als de ijzer. Daarom wordt het gebruikt bij de productie van diodes, LED's, transistors en temperatuur-, licht- en magnetische veldsensoren;
* In thermometers die worden gebruikt voor zeer hoge temperaturen;
* Bij de vervaardiging van metaallegeringen die lage smeltpunten moeten hebben;
* Het verkrijgen van waterstofgas door contact tussen de aluminium-galliumlegering en water;
* De Ga-37 isotoop is radioactief en wordt gebruikt als tracer in tests om ziekten en tumoren op te sporen.
Door Jennifer Fogaça
Afgestudeerd in scheikunde



