
Soms kan het gebeuren minimale formule hetzelfde zijn als de molecuulformule van de verbinding; dit is echter niet altijd waar.
De empirische of minimale formule voor water is bijvoorbeeld H2O, wat aangeeft dat er een verhouding van 2:1 is tussen de elementen waaruit watermoleculen bestaan. En dat is toevallig ook de molecuulformule van water. Om echter te zien dat dit niet altijd gebeurt, kijkt u naar de twee onderstaande voorbeelden:
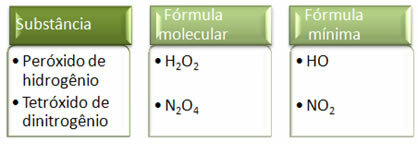
Aangezien de minimumformule alleen de verhouding van de atomen van elk element is en niet de werkelijke hoeveelheid ervan in de molecuulformule, kan het voorkomen van verschillende verbindingen met dezelfde empirische formule en zelfs de minimumformule van een verbinding kan hetzelfde zijn als de molecuulformule van andere. Merk in het onderstaande voorbeeld op hoe dit kan gebeuren:
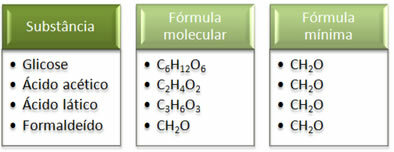
Zie dat de minimumformule CH2Het is hetzelfde voor alle stoffen, dat wil zeggen, deze minimale formule drukt uit dat in alle gevallen de koolstof-, waterstof- en zuurstofatomen zijn aanwezig in molecuulformules in een verhouding van 1:2:1. Bovendien is formaldehyde de enige die dezelfde molecuulformule heeft als de empirische formule.
- Minimale of empirische formuleberekening:
Om de empirische formule van een verbinding te bepalen, is het eerst nodig om te weten wat het percentage of de proximale formule is. Dit kan worden gedaan door de massa van elk element in 100 g van een monster te meten. De tekst "Percentage of centesimale formule’ verduidelijkt deze zaak beter.
Niet stoppen nu... Er is meer na de reclame ;)
Laten we bijvoorbeeld zeggen dat de dichtstbijzijnde samenstelling van een bepaalde verbinding wordt gegeven door: 40,00% C, 6,67% H en 53,33% O. We geven deze waarden door aan gram, rekening houdend met een massa van 100 g compostmonster. We hebben dus: 40 g C, 6,67 g H en 53,33 g O.
Nu is het nodig om deze waarden door te geven aan de hoeveelheid materie (mol). We doen dit door elk van de gevonden waarden te delen door hun respectievelijke molmassa's:
C: 40/12 = 3.33
H: 6,67/1 = 6,67
O: 53,33/16 = 3,33
Omdat de waarden geen gehele getallen zijn, gebruiken we het volgende apparaat: we delen alle waarden door de kleinste ervan, zodat de verhouding ertussen niet verandert.
In dit geval is de kleinste waarde 3,33, dus het resultaat is:
C: 3,33/3,33 = 1
H: 6,67/3,33 = 2
O: 3,33/3,33 = 1
De minimumformule van deze onbekende stof is dus gelijk aan: Ç1H2O1 of CH2O.
Kort samengevat zijn de stappen die nodig zijn om de empirische of minimale formule van een stof te vinden:

Door Jennifer Fogaça
Afgestudeerd in scheikunde
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
FOGAÇA, Jennifer Rocha Vargas. "Minimale of empirische formule"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/formula-minima-ou-empirica.htm. Betreden op 28 juni 2021.

