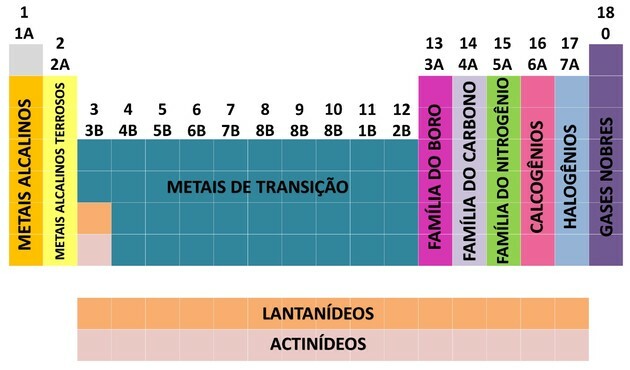
Een van de manieren waarop chemische elementen worden georganiseerd, is via families, die overeenkomen met de verticale reeksen van het periodiek systeem.
Bij 18 kolommen van de tabel groepeer de elementen volgens overeenkomsten in chemische eigenschappen.
Het organiseren van chemische elementen in families was een praktische manier om de verschillende gevonden informatie te structureren en op een eenvoudige manier weer te geven.
Om de locatie van een chemisch element te vergemakkelijken, werden families als volgt aangeduid in nummers van 1 tot 18:
Door de bijdrage van vele wetenschappers en verschillende pogingen om de gegevens te ordenen, evolueerde het periodiek systeem, waardoor een volgorde werd gecreëerd om de elementen te rangschikken.
Naamgeving van families
- De families in de tabel zijn onderverdeeld in A (representatief) en B (overgang), te herkennen aan letters en cijfers.
- U Representatieve elementen families 0, 1A, 2A, 3A, 4A, 5A, 6A en 7A komen overeen.
- U overgangselementen families 1B, 2B, 3B, 4B, 5B, 6B, 7B en 8B komen overeen.
- Door vaststelling van de International Union of Pure and Applied Chemistry (IUPAC), werden de families geïdentificeerd in groepen van 1 tot 18.
Periodiek systeem en elektronische distributie
De overeenkomsten tussen de elementen van dezelfde familie ontstaan doordat het aantal valentie-elektronen van het atoom in de grondtoestand hetzelfde is voor de leden van een bepaalde groep.
Bijvoorbeeld:
| Groep 1 | Elektronische distributie |
|---|---|
| 3lezen | 2-1 |
| 11Bij | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87vr | 2-8-18-32-18-8-1 |
Groep 1 atomen hebben hun elektronen verdeeld over meer dan één energieniveau, maar hebben allemaal een valentie-elektron.
Daarmee constateren we dat het maken van de elektronische distributie van het atoom in de grondtoestand vinden we zijn positie op het periodiek systeem.
Representatieve elementen
Representatieve elementen vertonen relatief minder complex chemisch gedrag dan overgangselementen en vormen de meeste stoffen om ons heen.
Sommige van de representatieve elementfamilies krijgen speciale namen, zoals hieronder weergegeven:
Groep |
Familie | specifieke naam | naam oorsprong | elementen | elektronische configuratie |
|---|---|---|---|---|---|
| 1 | 1A | alkalimetalen | uit het latijn alkali, wat "grijs van planten" betekent. | Li, Na, K, Rb, Cs en Fr | ons1 |
| 2 | 2A | aardalkalimetalen | De term "aards" verwijst naar "bestaande op aarde". | Be, Mg, Ca, Sr, Ba en Ra | ons2 |
| 13 | 3A | borium familie | Naam van het eerste element van de familie. | B, Al, Ga, In, Tl en Nh. | ons2np1 |
| 14 | 4A | koolstof familie | Naam van het eerste element van de familie. | C, Si, Ge, Sn, Pb en Fl. | ons2np2 |
| 15 | 5A | Stikstof familie | Naam van het eerste element van de familie. | N, P, As, Sb, Bi en Mc. | ons2np3 |
| 16 | 6A | chalcogenen | uit het grieks krijtjes, omdat het elementen zijn die in kopererts worden gevonden. | O, S, Se, Te, Po en Lv. | ons2np4 |
| 17 | 7A | Halogenen | Griekse uitdrukking die zoutvormers betekent. | F, Cl, Br, I, At en Ts. | ons2np5 |
| 18 | 0 | Edelgassen | Het werd geacht niet te reageren met andere stoffen. | He, Ne, Ar, Kr, Xe, Re en Og. | 1s2 (Hij) of wij2np6 |
Door de tabel kunnen we zien dat:
- De hierboven gepresenteerde elementen zijn geclassificeerd als representatief omdat ze het meest energetische elektron hebben in een s- of p-subniveau.
- Elektronen zijn verdeeld over energieniveaus en n vertegenwoordigt het buitenste niveau van het atoom in de grondtoestand.
- De representatieve elementen behoren, volgens de aanbeveling van de IUPAC, tot de groepen of families 1,2,13,14,15,16,17 en 18.
O waterstof het is apart ingedeeld van de andere elementen. Zelfs met 1s elektronische configuratie1, hij maakt geen deel uit van groep 1 voor het vertonen van een enkelvoudig gedrag.
overgangselementen
De overgangselementen komen overeen met de groepen 3 t/m 12. Ze krijgen deze naam omdat ze intermediaire eigenschappen hebben tussen groep 1 en 2 en de representatieve niet-metalen elementen.
U overgangsmetalen worden door IUPAC gedefinieerd als:
Een transitie-element heeft een onvolledig d-subniveau of kan kationen vormen met een onvolledig d-subniveau.
Wanneer het meest energetische elektron van het atoom in de grondtoestand zich in een onvolledig d-subniveau bevindt, wordt het gekenmerkt als een externe overgang.
Lanthaniden en actiniden zijn interne overgangselementen omdat ze ten minste één onvolledig f-subniveau hebben.
Wanneer de elementen elektronen hebben die de d- of f-orbitalen vullen, vertonen ze vergelijkbare eigenschappen en kunnen ze worden ingedeeld in elementen van uiterlijke of innerlijke overgang.
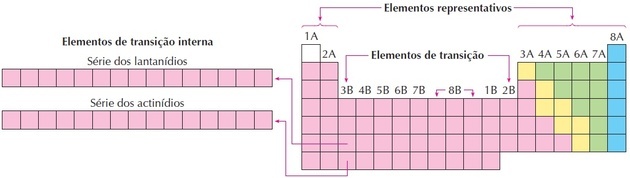
Zoals we in de afbeelding kunnen zien, komt familie 8B overeen met 3 kolommen, het zijn groepen 8, 9 en 10, die op deze manier zijn gegroepeerd omdat ze vergelijkbare kenmerken hebben.
Belangrijkste kenmerken van gezinnen
Onderstaande tabel toont de belangrijkste eigenschappen van de groepen in het periodiek systeem:
| Groep | Kenmerken | samengestelde stoffen vaker |
gebeurtenissen |
|---|---|---|---|
| 1 | Solide en glanzend in omgevingscondities. Zeer reactieve, zachte en goede geleiders van elektriciteit. | Zouten, hydroxiden en oxiden |
Reageer met halogenen en vorm zouten. |
| 2 | Minder reactief en harder dan groep 1. Zilvervaste stoffen met goede geleidbaarheid. | Zouten, hydroxiden en oxiden |
Vormen van zouten en oxiden. |
| 3 tot 12 | Ze vormen complexen. Het zijn metallische vaste stoffen, hard en broos, met uitzondering van kwik, dat een vloeistof is. | Zouten, oxiden en complexen. Bijv.: AgNO3, TiO en [Cr(OH)3(H2O)3] |
in mineralen in de vorm van oxiden. |
| 13 | Vaste stoffen in omgevingscondities, zilver, behalve borium. | Oxiden Bijv.: B2O3 |
in mineralen in de vorm van oxiden. |
| 14 | Solide in omgevingsomstandigheden. | Atomen van C en Si kunnen zich in ketens rangschikken en een grote verscheidenheid aan stoffen produceren. | In levende organismen en in de vorm van silicaten of oxiden. |
| 15 | Vaste stoffen, behalve stikstof, die onder omgevingsomstandigheden gasvormig is. | Oxiden en zuren Vb: NEE2 en H3STOF4 |
Sfeer, levende organismen en mineralen. |
| 16 | Vaste stoffen, behalve zuurstof, die onder omgevingsomstandigheden gasvormig zijn. | Sulfiden en oxiden Vb: ZnS en SiO2 |
Sfeer, levende organismen en mineralen. |
| 17 | Ze vormen diatomische moleculen en zijn zeer reactief. Het zijn slechte geleiders van elektriciteit en warmte. Ze zijn agressief naar levende wezens en het milieu. | Zuren en zouten. Vb: HCl en KBr |
Zijn aanwezig in stoffen organisch en mineraal. |
| 18 | Ze zijn zeer stabiel en worden aangetroffen in de vorm van gassen. | Ze vormen nauwelijks samengestelde stoffen. | Gassen in de atmosfeer. |
Chemische en fysische eigenschappen onderscheiden de ene familie van de andere. Zoals we hebben gezien, zijn chemische eigenschappen gerelateerd aan: elektronen van valentieen via hen interageert een atoom met een ander, verantwoordelijk voor het chemische gedrag en chemische bindingen gevormd.
De fysieke eigenschappen van elementen in dezelfde groep kunnen variëren afhankelijk van het atoomnummer en de massa.
Opdrachten
Nu u iets meer weet over de periodieke tabelfamilies, kunt u uw kennis testen en zien wat u hebt geleerd.
1) Beschouw het volgende uittreksel uit het periodiek systeem.
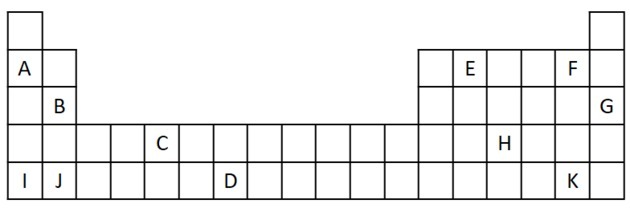
a) Noem twee elementen met twee valentie-elektronen.
b) Geef een element aan dat heftig reageert met water, waarbij een metaalhydroxide ontstaat.
c) Geef een niet-reactief element aan.
d) Geef twee elementen aan die samen met alkalimetalen zouten vormen.
Antwoord:
a) B en J
Twee valentie-elektronen komen overeen met groep 2, die een ns-elektronenconfiguratie heeft2 en worden in de oefening vertegenwoordigd door B en J.
b) A, B, I of J.
A en ik vertegenwoordigen elementen van familie 1; B en J komen uit familie 2. Zoals we in de eigenschappentabel zagen, zijn de elementen van groep 1 en 2 zeer reactief en kunnen ze hydroxiden vormen, zoals in de gegeven voorbeelden: KOH en Mg (OH)2.
c) G
Edelgassen zijn zeer stabiel en daarom niet erg reactief. De letter G is in de tabel ingevoegd als onderdeel van deze familie.
d) F en K
Halogenen reageren met alkalimetalen om zouten te vormen. Het meest voorkomende voorbeeld hiervan is keukenzout, NaCl.
2) De volgende afbeelding toont drie chemische elementen, van links naar rechts, lithium, natrium en kalium.

Selecteer de optie die elk van de volgende instructies correct aanvult.
1.1) "We kunnen zeggen dat lithium, natrium en kalium ...
(A) … behoren tot dezelfde periode.”
(B)... heeft hetzelfde atoomnummer.”
(C) … behoren tot dezelfde groep.”
(D) … heeft hetzelfde massagetal.”
1.2) "De elementen lithium, natrium en kalium...
(A) …heeft zeer vergelijkbare chemische eigenschappen.”
(B) …heeft heel verschillende chemische eigenschappen.”
(C) … zijn niet-metalen.”
(D) … reageren met water om zure oplossingen te vormen.”
antwoorden:
1.1) (C) behoren tot dezelfde groep.
1.2) (A) heeft zeer vergelijkbare chemische eigenschappen.
We kunnen deze informatie verkrijgen door het periodiek systeem te raadplegen of door de elementen lithium, natrium en kalium elektronisch te verspreiden. We zullen zien dat de drie een elektron in de valentieschil hebben en omdat ze deel uitmaken van dezelfde groep, lijken de chemische eigenschappen erg op elkaar.
3) Beschouw de volgende tabel, waarin de atoomnummers en elektronische distributies van sommige chemische elementen worden weergegeven.
| Element | chemisch symbool | atoomnummer | Elektronische distributie |
|---|---|---|---|
| Lithium | lezen | 3 | 2,1 |
| Beryllium | worden | 4 | 2,2 |
| Fluor | F | 9 | 2,7 |
| neon- | Huh | 10 | 2,8 |
| chloor- | kl | 17 | 2,8,7 |
| argon | Lucht | 18 | 2,8,8 |
| Kalium | K | 19 | 2,8,8,1 |
| Calcium | Hier | 20 | 2,8,8,2 |
Geef de groep van elk element aan.
Antwoord:
Lithium en kalium: groep 1. (Ze hebben een elektron in de valentieschil).
Beryllium en calcium: groep 2. (Ze hebben twee elektronen in de valentieschil).
Fluor en chloor: groep 17. (Ze hebben zeven elektronen in de valentieschil).
Neon en argon: groep 18. (Ze hebben acht elektronen in de valentieschil).
Controleer toelatingsexamenvragen met een becommentarieerde resolutie in Oefeningen op het periodiek systeem en ongepubliceerde vragen over het onderwerp in Oefeningen over het organiseren van het periodiek systeem.