O principe van Le Chatelier vertelt ons dat wanneer een verstoring wordt veroorzaakt in een systeem in evenwicht, deze zal verschuiven in de richting die de door die verstoring veroorzaakte krachten minimaliseert en een nieuw chemisch evenwicht herstelt.
Een van deze storingen is de temperatuurvariatie. Deze variatie is belangrijk omdat het niet alleen de evenwichtsverschuiving veroorzaakt, maar ook de waarde van de evenwichtsconstante, K. zal veranderenç.
Laten we een voorbeeld bekijken om beter te begrijpen hoe dit gebeurt:
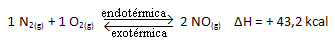
Kç = _[ BIJ DE]2___
[Nee2]. [O2]
De bovenstaande reactie vindt plaats in de directe richting met energieabsorptie, het is endotherm. Het omgekeerde proces vindt daarentegen plaats met het vrijkomen van energie, wat een exotherme reactie is.
Dus als we de temperatuur van het systeem verhogen, zal het chemische evenwicht verschuiven naar de endotherme reactie, die in deze reactie rechts is. Dit is zodat de warmte wordt geabsorbeerd en het evenwicht wordt herwonnen.
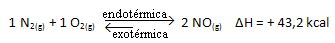
Het tegenovergestelde is ook waar; als we de temperatuur van dit systeem verlagen, zal de reactie verschuiven in de richting waarin het warmte zal afgeven, omdat de totale energie van de reactie zal afnemen. Dit betekent dat de balans zal verschuiven naar de exotherme reactie, die in dit geval naar links is:
Niet stoppen nu... Er is meer na de reclame ;)
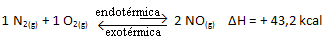
Kortom:

Ten opzichte van de evenwichtsconstante (Kç), wanneer de temperatuur stijgt, bevordert dit de endotherme reactie en meer NO(g) wordt gevormd, waardoor de concentratie wordt verhoogd en de concentratie van reactanten wordt verlaagd. Merk in de onderstaande formule op dat de concentratie van NO(g) is recht evenredig met de constante Kçdaarom neemt het ook toe:
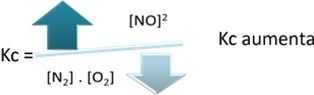
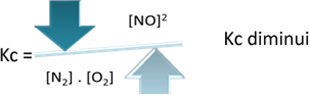
Maar als we de temperatuur verlagen en de reactie verschuiven naar de exotherme reactie, zal de concentratie van het NO-product afnemen en de concentraties van de reactanten toenemen. Omdat de concentraties van reactanten omgekeerd evenredig zijn met de constante Kc, zal deze afnemen:
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
FOGAÇA, Jennifer Rocha Vargas. "Temperatuurvariatie en chemische evenwichtsverschuiving"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/variacao-temperatura-deslocamento-equilibrio-quimico.htm. Betreden op 28 juni 2021.
Chemie

Test je kennis en leer meer met deze lijst met opgeloste oefeningen over chemische balansen. Door dit materiaal zul je beter kunnen begrijpen hoe je evenwichtsconstanten (Kp, Kc en Ki), evenwichtsverschuiving, pH en pOH, evenals evenwicht in zogenaamde bufferoplossingen kunt bewerken.


