optische isomeer is een soort ruimtelijke isomerie waarvan het hoofddoel is om het gedrag te bestuderen van moleculen die asymmetrie vertonen, dat wil zeggen, die elkaar niet overlappen.

linker spiegelbeeld
Moleculen die niet over elkaar heen kunnen worden gelegd (asymmetrische moleculen) kunnen worden vergeleken met de rechterhand en zijn spiegelbeeld. In de bovenstaande afbeelding hebben we dat het spiegelbeeld van de linkerhand de rechterhand is, die elkaar niet overlappen.
De belangrijkste verschillen tussen moleculen die aanwezig zijn: optische isomerie zijn in de invloed die ze veroorzaken of niet in de gepolariseerd licht, het al dan niet kunnen afbuigen van licht, en in relatie tot hun fysische en chemische eigenschappen.
Beweren dat een stof heeft optische isomerie, moeten we in zijn moleculen zoeken naar de aanwezigheid van ten minste één asymmetrische koolstof (ook wel chirale koolstof genoemd), een koolstof die vier verschillende liganden heeft, zoals in het volgende voorbeeld:

Carbon met vier verschillende bindmiddelen
De koolstof hierboven heeft de waterstof (H), methyl (CH) liganden3), broom (Br) en ethyl (H3C-CH2) en is daarom een chiraal koolstofatoom.
Bekijk nu de soorten isomeren die zijn bestudeerd in Optisch isomerie:
Actieve optische isomeren
Ook wel genoemd optische antipoden, enantiomorfen of chirale moleculen, zijn organische moleculen die het vermogen hebben om de richting van gepolariseerd licht naar links of rechts te verschuiven.
Het molecuul van een organische verbinding dat licht naar rechts kan afbuigen, wordt a. genoemd rechtshandig. Het molecuul van dezelfde organische verbinding dat in staat is om licht naar links te verschuiven heet is linksdraaiend.
Niet stoppen nu... Er is meer na de reclame ;)
Elke organische verbinding met een chirale koolstof heeft automatisch een rechtshandige molecuul en een linkshandige molecuul. Als een bepaalde organische verbinding echter meer dan één chiraal koolstofatoom heeft, moeten we de formule voorgesteld door wetenschapper Van't Hoff om het aantal rechtshandige moleculen te bepalen en levoreiras. Kijken:
IOA = 2Ç
IOA = optisch actieve isomeren;
C = aantal chirale koolstofatomen in het molecuul.
Inactieve optische isomeren
Ook wel genoemd racemisch mengsel, in de inactieve optische isomeren hebben we de aanwezigheid van hetzelfde aantal rechter- en linkermoleculen in een container. Dit mengsel heeft niet het vermogen om de richting van gepolariseerd licht naar links of naar rechts te verschuiven.
Volgens de regel voorgesteld door wetenschapper Van't Hoff, om het aantal racemische mengsels gevormd door een organische verbinding te bepalen, gebruikt u gewoon de volgende uitdrukking:
IOI = 2Ç
2
IOI = optisch inactieve isomeren;
C = aantal chirale koolstofatomen in het molecuul.
meso-isomeer
meso-isomeer is het molecuul met twee gelijke chirale koolstofatomen, dat wil zeggen, beide koolstoffen hebben dezelfde vier liganden, zoals in het volgende voorbeeld:

Wijnsteenzuur heeft een meso-isomeer
De liganden voor koolstof 2 en 3 zijn precies hetzelfde: een hydroxyl (OH), een carboxyl (COOH), een waterstof (H) en de carbohydroxyl carboxylgroep (CHOHCOOH).
Omdat het meso-isomeer twee gelijke chirale koolstofatomen heeft, wordt het effect van een van deze koolstoffen op gepolariseerd licht tenietgedaan door het effect van de andere koolstof. Daarom is het een optisch inactief isomeer.
Door mij Diogo Lopes Dias
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
DAGEN, Diogo Lopes. "Wat is optische isomerie?"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria-optica.htm. Betreden op 28 juni 2021.
Chemie
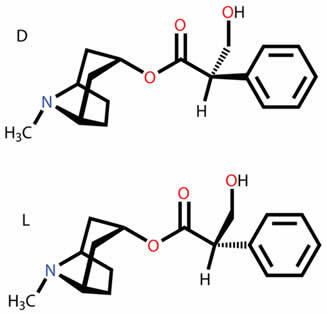
Weet waar de verschillende soorten vlakke en ruimtelijke isomeren over gaan, zoals functie, positie, keten, tautomerie, metamerie, cis-trans geometrische en optische isomerie.