DE vormingsenthalpie, ook wel genoemd standaard vormingsenthalpie, of standaard vormingswarmte, is de berekening van de warmte die vrijkomt of wordt opgenomen bij de vorming van 1 mol van een stof uit eenvoudige stoffen, in de standaardtoestand.
Het is onmogelijk om de absolute waarde van de enthalpieën van elke stof te berekenen, maar het is mogelijk om de variatie in de enthalpie die optreedt bij de reactie te berekenen met behulp van een calorimeter.
Het is noodzakelijk om te onthouden dat er werd overeengekomen om de enthalpiewaarde gelijk aan nul aan te nemen voor eenvoudige stoffen in de standaardtoestand. Dus als we willen weten wat de enthalpie is van de vorming van een stof, hoeven we alleen de waarde van de enthalpie van zijn vormingsreactie te kennen van eenvoudige stoffen.
We willen bijvoorbeeld de enthalpie van 18 gram water vinden, wat overeenkomt met 1 mol, aangezien de molmassa 18 g/mol is. Om dit te doen, hebben we eerst de reactie nodig om water te vormen uit eenvoudige stoffen, zoals hieronder weergegeven:
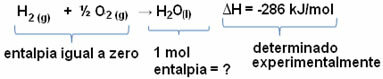
Merk op dat de waarde van de enthalpieverandering die in deze reactie optrad, experimenteel werd bepaald door middel van een calorimeter en gelijk is aan -286 kJ/mol.
De formule die deze enthalpieverandering (ΔH) berekent is:
ΔH = HProducten - HReagentia
Dus, omdat we de waarde van ΔH al kennen en dat de enthalpie van de reactanten gelijk is aan nul (aangezien het eenvoudige stoffen zijn in de standaardtoestand), kunnen we concluderen dat de enthalpiewaarde van 1 mol water gelijk is aan de enthalpieverandering van de formatiereactie, aangezien dit het enige product van die reactie is, zoals weergegeven balg:
ΔH = HProducten - HReagentia
-286 kJ/mol = HH2O - (HH2 + H1/2 O2)
-286 kJ/mol = HH2O - 0
HH2O = - 286 kJ/mol
Dit type enthalpie, verkregen uit de enthalpie van eenvoudige stoffen in de standaardtoestand, is daarom de standaard vormingsenthalpie (ΔH0).
Nu zijn er veel stoffen die niet direct door een enkele reactie worden gevormd, zoals water. In dergelijke gevallen kan de vormingsenthalpie worden berekend uit de enthalpievariatie van de reactie.
Bijvoorbeeld NH4Cl wordt gevormd door de volgende reactie:
NH3 + HCl → NH4kl ΔH = -176 kJ/mol
Merk op dat geen van de reactanten een eenvoudige stof is, dus we kunnen ze geen enthalpie van nul toekennen. We moeten de vormingsenthalpieën van elk van de reagentia kennen, omdat deze worden gevormd door reacties tussen eenvoudige stoffen:
NH3: ΔH = -46 kJ/mol
HCl: ΔH = -92,4 kJ/mol
Als we deze twee enthalpieën bij elkaar optellen, krijgen we de waarde van de enthalpie van de reactanten en kunnen we de enthalpie van NH vinden4kl:
HR = HNH3 + HHCl
HR = (-46 + (-92,4) kJ/mol)
HR = -138,4 kJ/mol
Substitueren in de formule:
ΔH = HProducten - HReagentia
-176 = HNH4Cl - ( -138,4)
HNH4Cl = - 176 - 138,4
HNH4Cl = -314,4 kJ/mol
In dit geval hebben we de waarden van de vormingsenthalpieën van de reactanten direct opgeteld omdat de reactieverhouding slechts 1 mol was. Als echter bij andere reacties de hoeveelheid mol verschillend is, zal het nodig zijn om eerst de vormingsenthalpie van de reactant te vermenigvuldigen met het aantal mol.
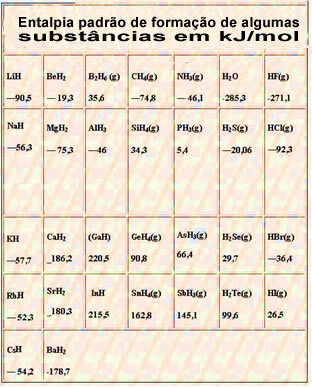
Hieronder staat een tabel met de standaard vormingsenthalpie van sommige stoffen bij 25 °C en 1 atm:
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm



