Bij intermoleculaire krachten, in het algemeen genoemd Van der Waals Forces, er zijn er drie: geïnduceerde dipool-geïnduceerde dipool, waterstofbruggen en permanente dipool-permanente dipool. In deze tekst zullen we alleen de laatste van deze drie krachten beschouwen:
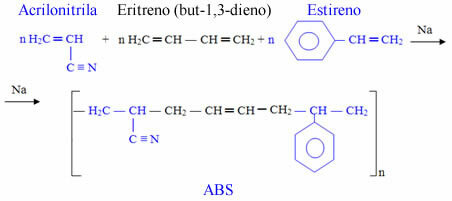
De kracht permanente dipool-permanente dipool, of gewoon, dipool-dipool komt alleen voor in polaire moleculen, dat wil zeggen degenen die geen uniforme belastingsverdeling over het oppervlak hebben. Om een voorbeeld te noemen: in het HCl-molecuul (zoutzuur) is de elektronische wolk meer verplaatst naar het chlooratoom, omdat het meer elektronegatief is dan waterstof.
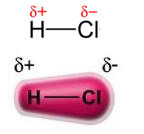
Merk op dat er rond het chlooratoom een opeenhoping van elektronen is, waardoor de vorming van a negatieve pool, die wordt gesymboliseerd door de Griekse letter delta (-δ). Hierdoor is in het gebied rond het waterstofatoom a positieve pool (+δ), omdat het een lage elektronische dichtheid heeft. Het HCl-molecuul vormt dan a elektrische dipool en daarom is er bij contact met andere naburige HCl-moleculen een aantrekkingskracht tussen de tegenovergestelde polen van de moleculen, zoals hieronder te zien is:
Deze aantrekkingskracht, die ontstaat tussen het negatieve uiteinde van de dipool van een molecuul met het positieve uiteinde van de dipool van een ander molecuul, vormt de dipool-dipoolkracht..
Dus, zoals de naam al zegt, de dipool is permanent, dus het komt alleen voor in polaire verbindingen. En hoe hoger de polariteit van een molecuul, hoe intenser de dipool-dipool-interacties in de stof.
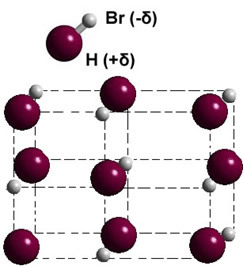
Als het zich in de vaste fase bevindt, leidt de vorming van de permanente dipool de positie van elk molecuul in de ruimte, waardoor dipolaire kristallen; zoals in het geval van waterstofbromide hieronder geïllustreerd:
Andere voorbeelden van polaire stoffen die de dipool-dipoolsterkte tussen hun moleculen hebben zijn: H2S, CO, HCCl3, ENKEL EN ALLEEN2.
Deze intermoleculaire kracht is van gemiddelde intensiteit, omdat het sterker is dan de geïnduceerde dipool-geïnduceerde dipoolaantrekkingskracht, maar minder intens dan de waterstofbinding. Dit is de reden waarom hun smelt- en kookpunten hoger zijn dan die van stoffen met een geïnduceerde dipoolsterkte. Omdat de permanente dipoolkracht sterker is, is het nodig om meer energie te leveren om de interacties van de moleculen af te breken.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm