Radioactiviteit is de eigenschap die sommige atomen, zoals uranium en radio-, moet spontaan afgeven energie in de vorm van deeltjes en Golf, worden chemische elementen stabieler en lichter.
Types
Radioactiviteit presenteert zich met twee manieren verschillende stralingen: deeltje — alfa (α) en bèta (β); en elektromagnetische golven — gammastralen (γ).
alfastralen: het zijn positieve deeltjes bestaande uit twee protonen en twee neutronen en met een laag penetratievermogen.
bètastralen: zijn negatieve deeltjes die geen massa bevatten die bestaat uit een elektron (verwaarloosbare massa), en hun penetratievermogen is groter dan dat van alfastralen, maar kleiner dan dat van gammastralen.
Gamma: het zijn elektromagnetische golven met hoge energie en aangezien het geen deeltjes zijn, hebben ze ook geen massa.
Lees ook: Radioactiviteit formules
Niet stoppen nu... Er is meer na de reclame ;)
wetten
De radioactieve emissie van deeltjes volgt bepaalde gedragingen die worden verklaard door de wetten van radioactiviteit (één voor het alfadeeltje en één voor het bètadeeltje), die werden beschreven door de chemicus Engels
Frederick Soddyen door de Poolse scheikundige en natuurkundige Kazimierz Fajans.Eerste wet van radioactiviteit
Volgens deze wet, wanneer een radioactief atoom alfa-type straling uitzendt, zal het aanleiding geven tot a nieuw atoom met kern bevattende twee protonen en twee neutronen minder, in totaal een massa vier eenheden kleiner. We kunnen de eerste wet van radioactiviteit weergeven met de volgende generieke vergelijking:
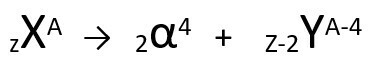
Algemene vergelijking van de eerste wet van radioactiviteit.
Laten we een voorbeeld bekijken:
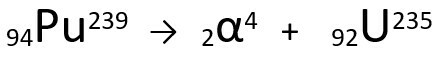
Vergelijking die de α-deeltjesemissie door Plutonium-239 weergeeft.
Merk op dat, wanneer een alfastraling wordt uitgezonden, het nieuw gevormde atoom, uranium-235, een massagetal heeft dat vier eenheden kleiner is en het atoomnummer twee eenheden kleiner - precies de waarden die overeenkomen met het α-deeltje dat wordt uitgezonden door de kern van de plutonium. Ga voor meer informatie naar: Eerste wet van radioactiviteit of First Soddy's Law.
Tweede wet van radioactiviteit
De tweede wet spreekt over de bèta-probleem. Wanneer een atoom een bètadeeltje uitzendt, bestaande uit een elektron en met een verwaarloosbare massa, is zijn atoom massa stoffelijk overschot onveranderd het is van jou atoomnummer neemt met één eenheid toe. In het algemeen vertegenwoordigen we als volgt:
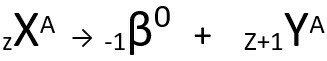
Algemene vergelijking van de tweede wet van radioactiviteit.
Zie het voorbeeld:
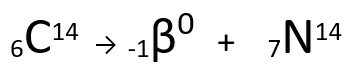
Vergelijking die de -deeltjesemissie door Carbon-14 weergeeft.
Het is te zien dat het gevormde stikstofatoom dezelfde massa heeft als het C-14-atoom, dat wil zeggen, ze zijn isobaren, en het atoomnummer neemt met één eenheid toe. de toename van atoomnummerwerd uitgelegd door de wetenschapper Henrico Fermi, die voorstelde dat een van de neutronen van de kern ondergaat een transmutatie, volgens de volgende vergelijking, genereren eenelektron(het uitgezonden bètadeeltje), een neutrino(een subatomair deeltje zonder elektrische lading en zonder massa, ) en een proton(P).
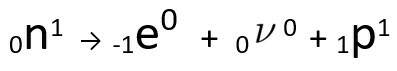
Vergelijking die de neutronentransmutatie weergeeft, volgens de hypothese van Fermi.
O elektron het is de neutrino worden afgegeven aan uit de kern, overblijvend enkel en alleen het proton, wat de toename van het atoomnummer verklaart. Ga voor meer informatie naar: Tweede wet van radioactiviteit of tweede wet van Soddy.
Lees ook: Verschil tussen radioactieve besmetting en bestraling
toepassingen
ondanks de negatieve mening die afzetting op radioactiviteit, het heeft belangrijke toepassingen in ons dagelijks leven, bijvoorbeeld in de productie van elektriciteitin kerncentrales door splijtingvan radioactieve atomen.
Momenteel gebruikt Brazilië de nucleaire energie als belangrijkste energiebron, maar het heeft kerncentrales (Angra 1 en 2) die werken om het land van elektriciteit te voorzien. We kunnen ook de. noemen materiële dating gevonden door archeologen met behulp van koolstof-14.

Kerncentrale Rio de Janeiro, Brazilië
Een andere fundamentele rol die radioactiviteit speelt, is gerelateerd aan het gebied van de geneeskunde, zoals in röntgenfotoen in de CT-scans, en ook in sommige soorten kankerbehandeling.
Lees ook: Belangrijkste risico's van kernenergieopwekking voor het milieu
natuurlijke radioactiviteit
dagelijks zijn we blootgesteld De kleine hoeveelheden van straling, hetzij kunstmatig of natuurlijk. Natuurlijke radioactiviteit komt spontaan in de natuur voor. Een deel van deze straling die we ontvangen, komt van het voedsel dat dagelijks wordt geconsumeerd, zoals Radon-226 en Kalium-40, die worden gepresenteerd in zeer lage niveaus en ze leggen geen risico's op onze gezondheid of schaden de voedingswaarden van voedingsmiddelen.
Dit proces van blootstelling van voedsel aan radioactieve emissies is bedoeld om: voedsel bewaren en promoot een Plantengroei. Enkele voorbeelden van voedingsmiddelen die straling afgeven zijn: Paranoten, banaan, bonen, rood vlees, onder anderen.
Ontdekking
De studie van radioactiviteit begon met onderzoek door de Duitse natuurkundige Wilhelm Röentgen, in 1895, toen hij onderzoek deed naar de effect vanluminescentie. Een andere belangrijke wetenschapper voor de ontwikkeling van radioactiviteit was de Franse natuurkundige Antoine-Henri Becquerel, die in 1896 merktekens opmerkte die op fotografische film waren aangebracht door een monster van uraniumzout.
Het was echter de Curie paar die de term radioactiviteit voor het eerst gebruikte. In 1898, de Polen Marie Curie volgde de studies met betrekking tot radioactiviteit op en deed waardevolle ontdekkingen voor het gebied, zoals de ontdekking van twee nieuwe radioactieve elementen: polonium (Po) en radium (Ra).
posterieur, Ernest Rutherford ontdekte de alfa-type straling (α) en bèta (β), wat een betere verklaring voor zijn atomaire model mogelijk maakte, evenals de vooruitgang van onderzoek met betrekking tot radioactiviteit.
Lees ook:Marie Curie: biografie, bijdragen en nalatenschap
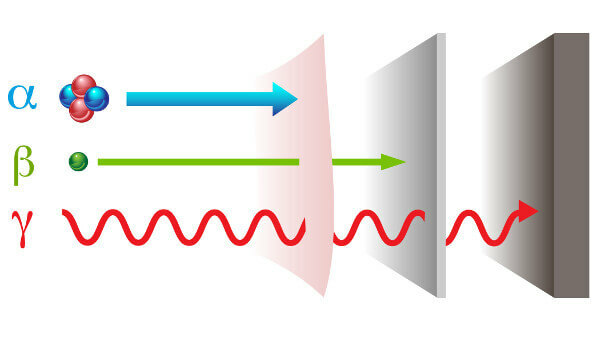
Soorten straling en hun penetratievermogen.
verval
O radioactief verval (of transmutatie) is de natuurlijk proces waar men onstabiele kern zendt straling uit, achtereenvolgens, om zo te verlaag je energie en stabiel worden.
Dit gebeurt normaal gesproken met atoomnummer atomen. groter dan 84, die atomen zijn met hoge instabiliteit nucleair vanwege de hoeveelheid positieve lading (protonen) die zich in de kern heeft opgehoopt. In dit proces wordt de neutronen zijn niet genoeg om alle protonen die in de kern zijn geclusterd te stabiliseren, en dan begint de kern radioactief verval te ondergaan totdat het atoomnummer minder dan 84 is.
In sommige gevallen kan het voorkomen dat atomen met een atoomnummer van minder dan 84 onstabiele kernen hebben en ook: gaan door het vervalproces, maar daarvoor moeten ze een aantal protonen hebben dat ruim boven het aantal neutronen.
Radioactief verval is berekend door halfwaardetijd (of periode van semi-desintegratie, P) van de radio-isotoop, wat de tijd is die nodig is om de helft van de massa van het oorspronkelijke radioactieve monster te desintegreren, dat wil zeggen stabiel te worden. Grafisch gezien wordt het concept van de halfwaardetijd hieronder weergegeven. Omdat het een continu proces, de curve neigt te bereiken nul.
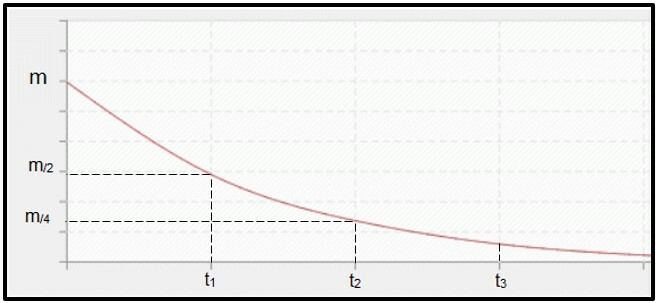
Grafiek die de halfwaardetijd weergeeft.
Berekeningen met radioactief verval volgen de volgende formules:
Formule voor het berekenen van de resterende massa na de halfwaardetijd:
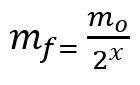
mf – eindmassa
mO – beginmassa
x - aantal verstreken halfwaardetijden
Formule voor het berekenen van de desintegratietijd van een radioactief monster:
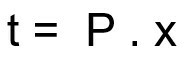
t - desintegratietijd
P - halfwaardetijd
x - aantal verstreken halfwaardetijden
radioactieve elementen
Er zijn twee soorten radioactieve elementen: u natuurlijk en de kunstmatig. De natuurlijke hebben elementen die in de natuur worden gevonden, al met hun onstabiele kernen, zoals de uranium, O actinium het is de radio-. Kunstmatige worden geproduceerd door processen die de kern van een atoom destabiliseren. In dit geval kunnen we de astatine het is de francium.
De belangrijkste radioactieve elementen zijn: uranium-235, kobalt-60, strontium-90, radium-224 en jodium-131. Vanwege het brede gebruik in kerncentrales en kankerbehandelingen, komen deze elementen vaker voor in ons dagelijks leven. Ga voor meer informatie over dit onderwerp naar: radioactieve elementen.
Radioactief afval
Radioactief afval of nucleair afval het is de residu van de industrieën die in hun processen radioactief materiaal gebruiken dat geen praktische toepassing meer heeft. Dit afval komt voornamelijk van de kerncentrales het is van medische toepassingen.
De grote productie van radioactief afval is een milieuprobleem voor de hele wereld, vanwege de schaarse en ontoereikende verwijderingsvoorwaarden en opslag.
Deze residuen gaan gepaard met verontreiniging van de bodem, waterwegen en lucht, met als gevolg: vernietiging van het milieu geleidelijk. Bovendien vormen ze ook risico's voor de menselijke gezondheid, zoals: infecties, kanker en, in ernstigere gevallen van besmetting, kunnen ze leiden tot: dood.
opgeloste oefeningen
(PUC-Camp-SP) De atoombom, ook wel atoombom genoemd, heeft uranium-235-atomen als splijtbaar bestanddeel, , alfadeeltjesstralers
, alfadeeltjesstralers 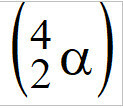 . Elk atoom van U-235 wordt bij het uitzenden van een alfadeeltje omgezet in een ander element, waarvan het atoomnummer gelijk is aan
. Elk atoom van U-235 wordt bij het uitzenden van een alfadeeltje omgezet in een ander element, waarvan het atoomnummer gelijk is aan
a) 231.
b) 233.
c) 234.
d) 88.
e) 90.
Sjabloon: Wanneer een atoom een alfadeeltje uitzendt, is er een afname van twee eenheden in het atoomnummer, volgens de eerste wet van radioactiviteit. Daarom: 92-2 = 90. Brief e.
(PUC-Camp-SP) Jodium-125, een radioactieve variant van jodium met medicinale toepassingen, heeft een halfwaardetijd van 60 dagen. Hoeveel gram jodium-125 blijft er na zes maanden over op basis van een monster met 2,00 g van de radio-isotoop?
a) 1.50
b) 0,75
c) 0,66
d) 0.25
e) 0.10
Sjabloon: Eerst wordt het aantal verstreken halfwaardetijden tijdens de 180 dagen berekend:
t = P. X
180 = 60. X
x = 3
Zodra het aantal verstreken halfwaardetijden is gevonden, wordt de massa berekend die aan het einde van de 180 dagen overblijft:
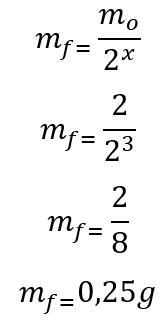
Daarom zal aan het einde van de zes maanden 0,25 g van de radio-isotoop van jodium-135 overblijven. Brief D.
Door Victor Felix
Afgestudeerd in scheikunde