Het atoomnummer, gesymboliseerd door de letter Z, komt overeen met het aantal protonen dat aanwezig is in de kern van het atoom van een bepaald chemisch element. Het atoomnummer van waterstof is bijvoorbeeld 1, wat betekent dat het slechts 1 proton in zijn atoomkern heeft.
Het atoomnummer verschijnt meestal naast het subscriptsymbool van het chemische element (in de benedenhoek) aan de linkerkant. Voorbeeld: 1H.
In de grondtoestand is het atoomnummer gelijk aan het aantal elektronen, aangezien in deze toestand het element is neutraal, daarom moet het aantal positieve ladingen (protonen) gelijk zijn aan het aantal negatieve ladingen (elektronen) van de atoom.
Het atoomnummer is belangrijk omdat: hij is het die de belangrijkste kenmerken en eigenschappen van het element bepaalt, evenals het gedrag en de locatie ervan in het periodiek systeem. De elementen worden vermeld in het periodiek systeem in oplopende volgorde van atoomnummer, dat meestal boven het element verschijnt, zoals hieronder weergegeven. Merk op dat het eerste element waterstof is, H (Z = 1), gevolgd door helium, He (Z = 2), dan komt lithium, Li (Z = 3), enzovoort.
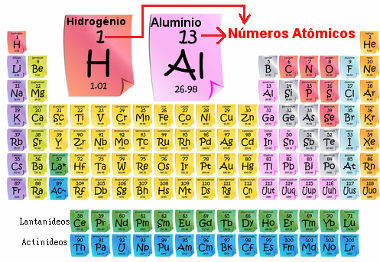
Atoomaantal elementen in het periodiek systeem
We kunnen een scheikundig element zelfs conceptualiseren als zijnde: "een verzameling atomen met hetzelfde atoomnummer". Dus als we het bijvoorbeeld hebben over het chemische element zuurstof, hebben we het over atomen met atoomnummer 8. Hieronder hebben we de atomen van de chemische elementen uit periode 1 en 2 van het Periodiek Systeem in oplopende volgorde van atoomnummer:

Chemische elementen uit perioden 1 en 2 van het periodiek systeem in oplopende volgorde van atoomnummer
Niet stoppen nu... Er is meer na de reclame ;)
De atoomnummers werden aanvankelijk gedefinieerd door de Engelse natuurkundige Henry Gwyn Jeffreys Moseley (1887-1915), en bij het uitvoeren van experimenten met het bombarderen van verschillende elementen chemici met röntgenstralen, merkte hij op dat de vierkantswortel van de frequentie van de röntgenstralen geproduceerd door de emissie van de atoomkern recht evenredig was met het atoomnummer van het element in de tabel Periodiek. Hiermee concludeerde hij dat het atoomnummer gerelateerd was aan de eigenschappen van atomen omdat het het aantal positieve ladingen in de kern van elk atoom vertegenwoordigde.
Chemische bindingen hebben geen invloed op het atoomnummer van atomen, omdat ze alleen betrekking hebben op elektronen die zich in de elektrosfeer bevinden. Kernreacties hebben echter betrekking op de atoomkern en daarom is ook het atoomnummer inbegrepen.
Wanneer bijvoorbeeld deeltjes (voornamelijk gematigde neutronen) op een zware, onstabiele atoomkern worden gebombardeerd, wordt die kern gebroken en geeft aanleiding tot twee kleinere atoomkernen, dat wil zeggen met een kleiner aantal protonen en neutronen, waardoor een kolossale hoeveelheid vrijkomt energie.
Kernfusie daarentegen is het tegenovergestelde proces, het is wanneer twee kleine en lichte kernen zich verenigen, waardoor een grotere en stabielere kern ontstaat, waarbij een nog grotere hoeveelheid energie vrijkomt.
Dus telkens wanneer deze kernreacties plaatsvinden, ontstaan er nieuwe chemische elementen, aangezien de atoomnummers van de initiële elementen verschillen van de atoomnummers van de laatste elementen. Zie hieronder bijvoorbeeld dat de splijting van uranium-235 met atoomnummer 92 aanleiding geeft tot barium (Z = 56), krypton (Z = 36) en drie neutronen:

Kernsplijtingsreactie van uranium-235
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
FOGAÇA, Jennifer Rocha Vargas. "Wat is atoomnummer?"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-numero-atomico.htm. Betreden op 27 juni 2021.


