intermoleculaire krachten het zijn de manieren waarop de moleculen van verbindingen (polair of niet-polair) gevormd door covalente bindingen met elkaar interageren. Ze werden in 1873 voorgesteld door de Nederlandse scheikundige en natuurkundige Diderik Van der Waals.
Volgens Van der Waals kunnen moleculen verschillend met elkaar omgaan. Deze verschillende interacties hebben een grote invloed op de smeltpunt (MP) en kookpunt (PE) van stoffen. De intensiteit waarmee de moleculen op elkaar inwerken, bepaalt dus hun fysieke toestand (vast, vloeibaar of gasvormig)).
Het bestaan van verschillende intermoleculaire krachten (interacties) waarnemen is eenvoudig, omdat we in de natuur dezelfde materie in verschillende fysieke toestanden kunnen vinden. Maak nu kennis met de drie soorten intermoleculaire krachten die kunnen bestaan tussen stoffen gevormd door covalente bindingen:
→ Londense troepen of dipool-geïnduceerde
Het is het soort kracht dat optreedt tussen niet-polaire moleculen, dat wil zeggen, moleculen die geen polen hebben (positief en negatief), omdat de elektronen gelijkmatig zijn verdeeld in hun elektrosfeer, zoals in de onderstaande afbeelding:
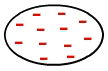
Uniforme verdeling van elektronen in een niet-polair molecuul
Op een gegeven moment kunnen elektronen zich echter ophopen in een gebied van een molecuul, waardoor er een negatieve en een positieve pool in ontstaat. Omdat dit molecuul zich dicht bij het andere bevindt, zorgt deze tijdelijke dipool ervoor dat de elektronen van het andere molecuul aan het ene uiteinde samenklonteren, enzovoort:

Vorming van een tijdelijke dipool in een niet-polair molecuul
Dus moleculen die niet-polair waren, hebben nu een dipool die werd geïnduceerd.
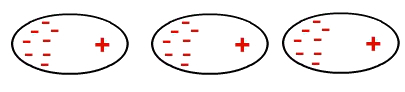
De interactie van niet-polaire moleculen vindt geïnduceerd plaats
Enkele voorbeelden van stoffen waarvan de moleculen door dit soort kracht op elkaar inwerken zijn: koolstofdioxide (CO2), methaangas (CH4), ethaangas (C2H6) en waterstofgas (H2).
Niet stoppen nu... Er is meer na de reclame ;)
→ Permanente dipool- of dipool-dipoolsterkte
Het is een soort intermoleculaire kracht die optreedt tussen polaire moleculen (behalve die waarbij het element waterstof direct gekoppeld is aan fluor, zuurstof of stikstof). Enkele voorbeelden van stoffen waarvan de moleculen interageren door dipool-dipool zijn de zoutzuur (HCl), zwaveldioxide (SO2), broomwaterstofzuur (HBr) en blauwzuur (HCN).
Omdat de moleculen polair zijn (ze hebben positieve en negatieve polen), werken ze op elkaar in zodat de negatieve pool van de ene zich verenigt met de positieve pool van de andere, enzovoort:
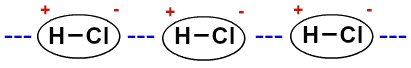
Weergave van de permanente dipool tussen zoutzuurmoleculen acid
Door de aanwezigheid van de dipool, aangezien de moleculen polair zijn, is de dipool-dipool interactie intenser dan de geïnduceerde dipool.
→ waterstofbruggen
Het is een soort intermoleculaire kracht die ook voorkomt in polaire moleculen, maar alleen als het waterstofatoom direct is gekoppeld aan een van de drie chemische elementen (fluor, zuurstof en stikstof) plus elektronegatieven van het periodiek systeem.
Enkele voorbeelden van moleculen die interageren door waterstofbruggen zijn: fluorwaterstofzuur (HF), ammoniak (NH3) en water (H2O).
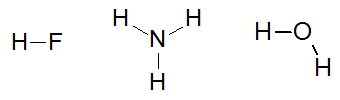
Structuurformules de stoffen fluorwaterstofzuur, ammoniak en water
Hoe waterstofbinding optreedt in moleculen waarvan het elektronegativiteitsverschil tussen atomen erg is groot, het is een intermoleculaire kracht van hoge intensiteit (groter dan de dipool-dipool en de dipool geïnduceerd).
Bekijk een weergave van deze interactie:
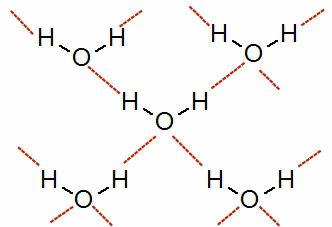
Weergave van waterstofbruggen tussen watermoleculen
Door mij Diogo Lopes Dias
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
DAGEN, Diogo Lopes. "Wat zijn intermoleculaire krachten?"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-sao-forcas-intermoleculares.htm. Betreden op 28 juni 2021.



