Net als de sulfonzuren en de amines, de isonitrillen zijn organische verbindingen die afkomstig zijn van anorganische stoffen, meer specifiek van een anorganisch zuur dat isocyaanwaterstofzuur wordt genoemd.
U isonitrillen worden veel gebruikt bij verschillende organische syntheses (productie van nieuwe organische stoffen) en bij de productie van pesticiden en pesticiden. Deze verbindingen ontstaan wanneer isocyaanzuur reageert met a alcohol, bijvoorbeeld. Bij deze reactie wordt het waterstofatoom van het zuur vervangen door de alcoholradicaal. Waterstof voegt zich bij de hydroxyl van alcohol en vormt een watermolecuul.
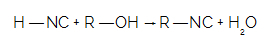
Wanneer HNC reageert met een alcohol, hebben we de vorming van isonitril en een watermolecuul
Het isocyaanwaterstofzuur waaruit isonitrilen ontstaan, heeft de volgende structuurformule:
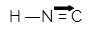
Tussen het koolstofatoom en het stikstofatoom bevindt zich een dubbele binding en een datieve binding. Dit gebied van isonitril is extreem polair vanwege het resonantieverschijnsel tussen de dubbele bindingselektronen en de datieve bindingselektronen.
Door het resonantie-effect tussen het koolstof- en stikstofatoom hebben isonitrillen een lagere stabiliteit ten opzichte van nitrillen, dat wil zeggen, ze kunnen ontleden (omgevormd worden in een andere stof) gemakkelijk. Dus wanneer een isonitril wordt verwarmd, wordt het gemakkelijk omgezet in een nitril.
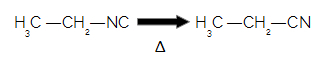
Bij het verwarmen van een isonitril verandert het in nitril
Niet stoppen nu... Er is meer na de reclame ;)
Wat betreft de fysieke kenmerken, isonitrilen:
zijn minder dicht dan water;
hoge smelt- en kookpunten hebben in vergelijking met stoffen met een geschatte molmassa;
De fysieke toestand hangt af van de grootte van de molaire massa. Isonitrilen met een hogere molmassa zijn vast;
Ze zijn slecht oplosbaar in water.
Om de. uit te voeren nomenclatuur van een isonitril, is de regel van de IUPAC (International Union of Pure and Applied Chemistry) als volgt:
Taknaam + carbylamine
OPMERKING: De naam carbylamine verwijst naar de NC-groep. Dus elke groep die aan de NC is gekoppeld, wordt in de nomenclatuur als een radicaal beschouwd.
Zie enkele voorbeelden:
Ethylcarbylamine: Isonitril met de ethylradicaal

Vinylcarbylamine: Isonitril met de vinylradicaal
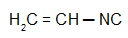
Isobutylcarbylamine: Isonitril met de isobutylradicaal
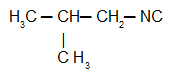
Naast de IUPAC-nomenclatuur, isonitrilen hebben nog steeds de gebruikelijke nomenclatuur, geleid door de volgende regel:
Isocyanide + de + radicale naam + a
Ethylisocyanide: Isonitril met de ethylradicaal

Vinylisocyanide: Isonitril met de vinylradicaal
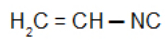
Isobutylisocyanide: Isonitril met de isobutylradicaal:
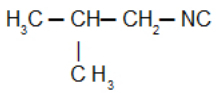
Door mij Diogo Lopes Dias
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
DAGEN, Diogo Lopes. "Isonitrillen"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/isonitrilos.htm. Betreden op 27 juni 2021.
Aminen, classificatie van aminen, amine-eigenschappen, primair amine, stikstofhoudende organische verbindingen, alkylradicalen, dimethylamine, ethylamine, trimethylamine, verbindingen gewonnen uit groenten, putrescine, cadaverine, organische basen, syntheses biologisch