“Chemische binding” was een term die voor het eerst werd gebruikt door Gilbert Newton Lewis in het jaar 1920 in een artikel om uit te leggen waarom dat atomen aan elkaar plakken om stoffen te vormen en ook waarom ze over duizenden aan elkaar plakken jaar oud.
De atomen van de meeste chemische elementen die tot nu toe bekend waren en in het periodiek systeem zijn vermeld, komen niet in geïsoleerde vorm in de natuur voor. De meeste materialen die in ons dagelijks leven aanwezig zijn, zijn stoffen die eenvoudig kunnen zijn (bestaande uit atomen van slechts één type chemisch element) of composieten (hebben atomen van twee of meer chemische elementen) veel verschillende).
Dit komt omdat atomen het vermogen hebben om chemische bindingen te maken met andere atomen, wat hetzelfde element of verschillende elementen kan zijn. Deze bindingen zijn zo sterk dat zonder enige invloed van buitenaf de atomen in de meeste gevallen verbonden blijven zoals ze zijn.
Mindmap: chemische bindingen

*Om de mindmap in PDF te downloaden, Klik hier!
Het is bijvoorbeeld niet gebruikelijk om een vrij zuurstofatoom in de natuur te vinden; we vinden echter verschillende stoffen waarin het lijkt te zijn gehecht aan andere atomen. Een voorbeeld van een eenvoudige stof is zuurstofgas waarin elk molecuul wordt gevormd door twee gebonden zuurstofatomen (O2); terwijl een voorbeeld van een samengestelde stof water is, waarbij elk molecuul twee waterstofatomen heeft gebonden aan een zuurstofatoom (H2O).
De enige elementen die stabiel geïsoleerd in de natuur voorkomen, zijn de edelgassen, dat wil zeggen, de elementen van familie 18 van het periodiek systeem (He, Ne, Ar, Kr, Xe en Rn). Al deze elementen hebben gemeen dat ze in de laatste elektronenschil (valentielaag) acht elektronen hebben, met uitzondering van helium (He), die slechts één elektronenschil (K-laag) heeft en daarom twee elektronen bevat, wat het maximaal mogelijke aantal elektronen is laag.
Zo heeft Gilbert N. Lewis en ook wetenschapper Water Kossel kwamen tot de conclusie dat: de atomen van de andere elementen binden om acht elektronen te hebben (of twee, als je alleen de K-schil hebt) en stabiliseren dus. Het is gemaakt, toen, de elektronische valentietheorie, die aangeeft hoeveel chemische bindingen het atoom van een element maakt, gebaseerd op het uitgelegde idee.
daarom, atomen maken chemische bindingen en proberen valentie-schilelektronen te verliezen, te winnen of te delen totdat ze de configuratie van het volgende edelgas bereiken.Deze theorie werd ook genoemd octetregel.
Zuurstof is bijvoorbeeld tweewaardig omdat het zes elektronen in zijn valentieschil heeft. Daarom moet het nog twee elektronen ontvangen om een configuratie te hebben van het edelgas-neon (Ne), dat wil zeggen met acht elektronen in de valentieschil, in dit geval de L-schil. In het geval van het genoemde zuurstofgas en water hebben we het volgende:
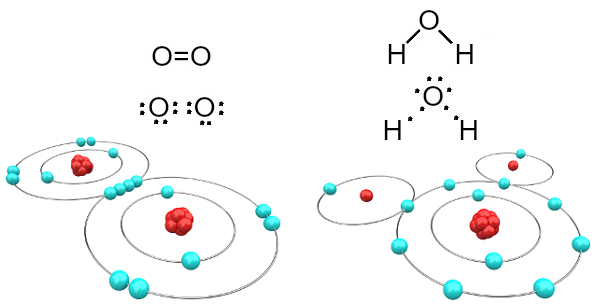
Zuurstof- en watermoleculen gevormd door covalente bindingen
Merk op dat in het eerste geval (zuurstofgas - O2), deelt elk zuurstofatoom twee elektronen, die beide acht elektronen in de valentieschil hebben. Dit betekent dat een dubbele binding (twee bindingen tegelijkertijd tussen twee atomen).
In het geval van water deelt elk van de twee waterstofatomen een elektron met het centrale zuurstofatoom en ze zijn allemaal stabiel (zuurstof heeft acht elektronen in de valentieschil en elke waterstof heeft er twee) elektronen). Ook hier worden twee eenvoudige verbindingen gemaakt.
Dit type chemische binding, waarbij alle atomen elektronen moeten ontvangen (waterstof, niet-metalen en halfmetalen) en waarin elektronen in paren worden gedeeld, heet covalente binding.
Maar er zijn nog twee soorten chemische bindingen:
(1) ionbinding → er is de definitieve overdracht van elektronen van het ene atoom naar het andere. Dit type binding vindt plaats tussen metaalatomen (die de neiging hebben om elektronen te verliezen om te blijven) stabiel) en waterstofatomen, niet-metalen en halfmetalen (die de neiging hebben om elektronen op te nemen om te blijven stal).
Een voorbeeld is natriumchloride (NaCl - keukenzout) waarbij natrium een metaal is dat de neiging heeft een elektron te verliezen, terwijl chloor een niet-metaal is dat de neiging heeft om een elektron op te nemen. Dus, natrium doneert(rode pijl)een elektron naar chloor, waarbij zout wordt gevormd, een zeer stabiele stof. Sinds ze afstuderen (zwarte Pijl) ionen, die chemische soorten zijn met tegengestelde ladingen (+ en -), trekt het ene ion een ander dichtbij aan en worden ionenclusters gevormd met een enorm aantal ionen, net als de kristallen in keukenzout.

Vorming van natriumchloride door ionische binding
(2) Metalen verbinding → Het is een theorie dat metalen (zoals aluminium, goud, zilver, koper, enz.) worden gevormd door een cluster van neutronenatomen en kationen die bij elkaar worden gehouden door een soort "wolk" van vrije elektronen (elektronen die verloren zijn gegaan bij de vorming van kationen aangehaald). Deze wolk (of zee) van elektronen zou fungeren als een metalen binding die de atomen bij elkaar zou houden.
Lees de gerelateerde artikelen hieronder voor meer informatie over dit soort chemische bindingen en de octetregel.
Mindmap door mij Victor Ricardo Ferrreira
Scheikundeleraar
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-uma-ligacao-quimica.htm

