Zoals vermeld in de tekst "Alfa-emissie (α)”, De Nieuw-Zeelandse chemicus Ernest Rutherford voerde een experiment uit waarbij hij een monster van een radioactief materiaal in een loden blok plaatste, met een gat om de radioactieve emissies te sturen; en onderwierp deze stralingen aan een elektromagnetisch veld.
Onder de verkregen resultaten merkte Rutherford op dat een stralingsbundel werd aangetrokken door de positieve plaat, wat hem ertoe bracht te concluderen dat deze emissies van negatieve lading. Deze straling werd genoemd stralenof bèta-emissies (β).
Omdat stralen afbuigingen ondergingen wanneer ze werden blootgesteld aan een elektromagnetisch veld, leidde dit hem ook tot de conclusie dat ze eigenlijk waren samengesteld uit deeltjes met massa. De massa van deze deeltjes was echter kleiner dan die van de deeltjes die de alfa-emissies vormden, omdat de β-deeltjes een grotere afwijking vertoonden.
- Grondwet:
In 1900 vergeleek de Franse natuurkundige Antoine-Henri Bequerel (1852-1908) deze afwijkingen van de bètadeeltjes met de verschuivingen die elektronen uitvoerden toen ze ook aan een veld werden onderworpen elektromagnetisch. Het resultaat was dat ze hetzelfde waren; daarmee werd gezien dat
bètadeeltjes waren eigenlijk elektronen.Als resultaat wordt de representatie van dit deeltje gegeven door 0-1β of β-. Merk op dat de bèta-emissie een massagetal (A) heeft dat gelijk is aan nul, aangezien de elektronen geen deel uitmaken van de atoomkern.
- Gevolgen van bètadeeltjesemissie voor de structuur van het atoom:
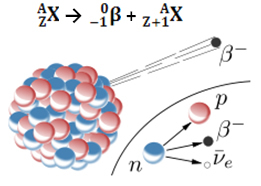
De emissie van een bètadeeltje (0-1β) is het resultaat van herschikking van de onstabiele kern van het radioactieve atoom om stabiliteit te verkrijgen. Daarom doet zich een fenomeen voor in de kern, waarin een neutron ontleedt, waarbij drie nieuwe deeltjes ontstaan: een proton, een elektron (deeltje β) en een neutrino. De antineutrino en het elektron worden uitgezonden; het proton blijft echter in de kern.
10Nee →11p + 0-1en + 00ν
neutron proton elektron neutrino
Dus, wanneer een atoom een bètadeeltje uitzendt, verandert het in een nieuw element met hetzelfde massagetal (omdat de neutron dat eerder bestond, werd "vervangen" door het proton), maar het atoomnummer (Z = protonen in de kern) neemt toe met een eenheid.
Zie hieronder hoe dit op een generieke manier gebeurt:
Hier is een voorbeeld van bètaverval dat optreedt met isotoop 14 van het element koolstof:

Bètastraling bestaat uit elektronen die met hoge snelheid worden uitgezonden door de kernen van radioactieve atomen, deze beginsnelheid is van 100 000 km/s tot 290.000 km/s en bereikt 95% van de snelheid van de licht.
De massa van -straling is gelijk aan die van een elektron, dat 1840 keer kleiner is dan die van een proton of neutron. Alfa (α) straling zendt twee protonen en twee neutronen uit, dus de massa van α-deeltjes is 7360 keer die van β-deeltjes. Dit verklaart het feit dat α-deeltjes een kleinere afwijking hebben dan β-deeltjes, zoals Rutherford in zijn experiment had geverifieerd.
- Penetratievermogen:
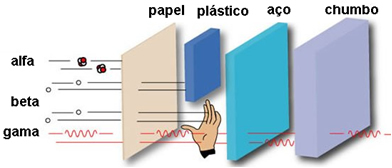
Het penetratievermogen is gemiddeld, 50 tot 100 keer doordringender dan alfadeeltjes. Deze kunnen door een vel papier gaan, maar worden vastgehouden door een vel van slechts 2 mm lood of 2 cm aluminium. Wanneer ze het menselijk lichaam aantasten, kunnen ze tot 2 cm doordringen.
- Schade aan mensen:
Omdat het penetratievermogen over het menselijk lichaam slechts 2 cm is, kunnen de β-deeltjes de huid binnendringen en brandwonden veroorzaken, maar worden gestopt voordat ze de meeste interne organen van het lichaam bereiken.
Door Jennifer Fogaça
Afgestudeerd in scheikunde


