O het aantal atoomdeeltjes berekenen calculating wordt gebruikt om de hoeveelheid protonen (in de kern), elektronen (in de elektrosfeer) en neutronen (in de kern) in een atoom of ion aan te geven. Om dit te doen, is het essentieel om enkele kenmerken van atomen te kennen:
1- Atoomgetal (Z)
Het is een wiskundige code, weergegeven door de hoofdletter Z, linksonder in de afkorting van een atoom:
ZX
Het geeft het aantal protonen (p) in de kern en het aantal elektronen (e) in de elektrosfeer van een atoom aan. Dus in algemene termen:
Z = p = e
2- Massanummer (A)
Het is een wiskundige code die overeenkomt met de som van het aantal protonen (p) en neutronen (n), beide aanwezig in de kern van een atoom. De vergelijking die het massagetal vertegenwoordigt, wordt gegeven door:
A = p + n
Aangezien het aantal protonen gelijk is aan het atoomnummer, kunnen we de vergelijking schrijven om het massagetal als volgt te berekenen:
A = Z + n
Als we het massagetal en het atoomnummer van een atoom weten, kunnen we het aantal neutronen als volgt bepalen:
n = A - Z
3- ionen
Het zijn atomen die elektronen verliezen of winnen. Ze hebben een positief of negatief teken rechtsboven in hun weergave, zoals in het volgende model:
X+ of X-
Positief ion: Dit wordt een kation genoemd en het positieve teken geeft aan dat het elektronen heeft verloren.
Negatief ion: Dit wordt een anion genoemd en het negatieve teken geeft aan dat het elektronen heeft gekregen.
Niet stoppen nu... Er is meer na de reclame ;)
4- Atomaire overeenkomsten
a) Isotopen
Atomen met hetzelfde atoomnummer en verschillende massagetallen. Voorbeeld:
7X14 en 7Y16
Atomen X en Y hebben hetzelfde atoomnummer (links van het acroniem), dat wil zeggen gelijk aan 7. Atoom X heeft een massagetal (rechts van het acroniem) gelijk aan 14, en atoom Y heeft een massagetal gelijk aan 16.
b) Isobaren
Atomen met hetzelfde massagetal en verschillende atoomnummers. Voorbeeld:
15X31 en 13Y31
Atomen X en Y hebben een massagetal (rechts van het acroniem) gelijk aan 31. Atoom X daarentegen heeft een atoomnummer gelijk aan 15 en atoom Y heeft een atoomnummer gelijk aan 13.
c) Isotonen
Atomen met verschillende massagetallen en atoomnummers, maar hetzelfde aantal neutronen.
d) Iso-elektronica
Atomen met hetzelfde aantal elektronen. Voorbeeld:
12X+2 en 7Y-3
Atoom X heeft een atoomnummer gelijk aan 12 en is een kation (met een positieve lading +2), dus het verliest twee elektronen en heeft dus 10 elektronen in zijn elektrosfeer. Atoom Y daarentegen heeft een atoomnummer gelijk aan 7 en is een anion (met negatieve lading -3), dus het krijgt drie elektronen, en heeft dus 10 elektronen in zijn elektrosfeer.
Mindmap: atoomdeeltjes
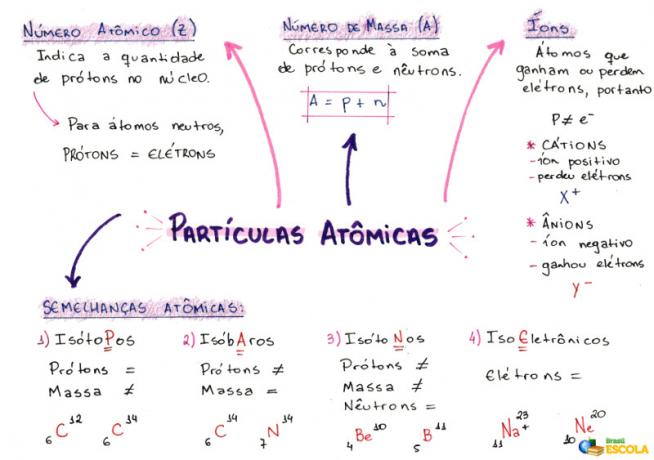
* Om de mindmap in PDF te downloaden, Klik hier!
Voorbeelden van het berekenen van het aantal atoomdeeltjes
Voorbeeld 1: Bepaal het aantal protonen, neutronen en elektronen in het atoom 14X29.
De volgende waarden voor het atoom X werden gegeven:
Massanummer (rechtsboven) = 29
Atoomgetal (linksonder) = 14
Om het aantal protonen te bepalen:
Het aantal protonen is altijd gelijk aan het atoomnummer, dus het X-atoom heeft 14 protonen.
Om het aantal elektronen te bepalen:
Omdat het atoom X geen ion is, is het aantal elektronen gelijk aan het aantal protonen, dat wil zeggen 14.
Om het aantal neutronen te bepalen:
Het aantal neutronen wordt bepaald met behulp van het aantal massa en protonen in de volgende formule:
A = p + n
29 = 14 + n
29 - 14 =n
n = 15
Voorbeeld 2: Bepaal het aantal protonen, neutronen en elektronen van ion X+3, wetende dat hun massagetal en atoomnummer respectievelijk 51 en 23 zijn.
De volgende waarden voor ion X werden gegeven:
Massanummer = 51
Atoomgetal (linksonder) = 23
Om het aantal protonen te bepalen:
Het aantal protonen is altijd gelijk aan het atoomnummer, dus het X-atoom heeft 23 protonen.
Om het aantal elektronen te bepalen:
Het ion X is positief (+3), dus het is een kation dat drie elektronen heeft verloren. Het aantal elektronen is dus 20.
OPMERKING: De afname of toename van het aantal elektronen vindt altijd plaats in relatie tot het atoomnummer.
Om het aantal neutronen te bepalen:
Het aantal neutronen wordt bepaald met behulp van het aantal massa en protonen in de volgende formule:
A = p + n
51 = 23 + n
51 - 23 =n
n = 28
Voorbeeld 3: Een atoom W heeft een atoomnummer en massa gelijk aan respectievelijk 29 en 57, isobaar van a atoom Y, dat een atoomnummer heeft dat gelijk is aan 30, dat isotoop is van een atoom B, waarvan het massagetal gelijk is aan 65. Bepaal met deze informatie het aantal protonen, neutronen en elektronen in atoom B.
Gegevens verstrekt door de oefening:
Atoom W
atoomnummer (linksonder) = 29
massagetal (rechtsboven) = 57
Y isobaar, dwz de massa van Y is ook 57.
Y-atoom
atoomnummer = 30
massagetal = 57
Met deze twee waarden moeten we het neutronengetal bepalen omdat het isotoon is van element B:
A = Z + n
57 = 30 + n
57 - 30 = n
n = 27
Een graftombe:
massagetal = 65
aantal neutronen = 27
Met deze gegevens moeten we het atoomnummer bepalen, omdat we daarmee het aantal protonen en het aantal elektronen bepalen (omdat het geen ion is):
A = Z + n
65 = Z +27
65 - 27 = Z
Z = 38
Daarom heeft het atoom B 38 protonen, 38 elektronen en 27 neutronen.
* Mindmap door Victor Ricardo Ferreira
Scheikundeleraar
Door mij Diogo Lopes Dias

