DE EersteWetgeeftThermodynamica is een toepassing van beginselgeeftbehoudgeeftenergie voor thermodynamische systemen. Volgens deze wet is de variatie van interne energie van een thermodynamisch systeem is het verschil tussen de hoeveelheid warmte geabsorbeerd door het systeem en het werk dat het doet.
Kijkenook:Fundamentele concepten en samenvatting van thermologie
Wat is de eerste wet van de thermodynamica?
De eerste wet van de thermodynamica is een direct gevolg van het principe van energiebesparing. Volgens dit principe is de totale energie van een systeemblijft altijd constant, omdat ze niet verloren is, maar getransformeerd.
Binnen het bereik van Thermodynamica, worden gebruikt meer specifieke begrippen en minder generiek dan die gebruikt in het principe van energiebesparing. In de eerste wet van de thermodynamica gebruiken we concepten als: energieintern,warmte en werk, die relevant zijn voor de reikwijdte van Thermische machines (technologische toepassingen van fundamenteel belang voor de thermodynamica).

Stel je een door stoom aangedreven machine voor, wanneer de werkvloeistof van die machine (waterdamp) warmte ontvangt van een externe bron, zijn er twee energieomzettingen mogelijk: stoom kan zijn eigen temperatuur- met een paar graden verhoogd of, zelfs, het kan uitbreiden en beweeg de zuigers van die machine, waardoor een bepaalde hoeveelheid. wordt uitgevoerd werk.
"De variatie in de interne energie van een thermodynamisch systeem komt overeen met het verschil tussen de hoeveelheid warmte die het absorbeert en de hoeveelheid werk die dit systeem verricht."
Formule van de eerste wet van de thermodynamica
De formule die wordt gebruikt om de eerste wet van de thermodynamica wiskundig te beschrijven, wordt hieronder weergegeven:

u – interne energievariatie (cal of J)
Vraag – warmte (limoen of J)
τ – werk (limoen of J)
Om deze formule te gebruiken, moeten we aandacht besteden aan enkele signaalregels:
U – zal positief zijn als de systeemtemperatuur stijgt;
U – zal negatief zijn als de systeemtemperatuur daalt;
Vraag – zal positief zijn als het systeem warmte opneemt uit de externe omgeving;
Vraag – het zal negatief zijn als het systeem warmte afgeeft aan de externe omgeving;
τ – het zal positief zijn als het systeem zich uitbreidt en werkzaamheden aan de externe omgeving uitvoert;
τ – het zal negatief zijn als het systeem contracteert en werk ontvangt van de externe omgeving.
interne energievariatie
De term ΔU verwijst naar de energieverandering die wordt toegeschreven aan de kinetische energie van de samenstellende deeltjes van het systeem, in het geval van een ideaal gas, kan worden gezegd dat ΔU gelijk is aan:
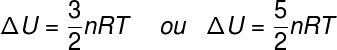
Nee – aantal mol (mol)
R – universele constante van ideale gassen (0,082 atm.l/mol. K of 8,31 J/mol. K)
T – absolute temperatuur (kelvin)
Als we de formules analyseren, kunnen we zien dat, als er geen temperatuurverandering in het systeem is, de interne energie blijft ook ongewijzigd. Verder is het belangrijk om te zeggen dat voor thermische machines, die in cycli werken, de variatie van de interne energie, aan het einde van elke cyclus, moet nul zijn, omdat de motor op dat moment weer werkt met de begintemperatuur.
Kijkenook:Prestaties van thermische machines: hoe wordt het berekend?
Warmte
Als we verder gaan met de volgende term, Q, die verwijst naar de hoeveelheid warmte die naar het systeem wordt overgebracht, gebruiken we meestal de fundamentele vergelijking van calorimetrie, hieronder weergegeven:
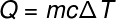
Vraag -hitte (limoen of J)
m – massa (g of kg)
ç – soortelijke warmte (cal/gºC of J/kg. K)
T – temperatuurvariatie (celsius of kelvin)
Werk
De laatste van de grootheden die verband houden met de eerste wet van de thermodynamica is werk (τ), dat a. heeft analytische formule alleen voor transformaties die plaatsvinden onder constante druk, ook bekend Leuk vinden isobare transformaties, kijk maar:
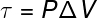
P – druk (Pa of atm)
V – volumevariatie (m³ of l)
Wanneer de druk die op het systeem wordt uitgeoefend niet constant is, kan het werk worden berekend door het gebied van de grafiek van druk versus volume (P x V). Ga voor meer informatie over deze scalaire omvang naar: werk.
opgeloste oefeningen
Vraag 1)(CefetMG) Het werk dat wordt uitgevoerd in een gesloten thermische cyclus is gelijk aan 100 J, en de warmte die betrokken is bij thermische uitwisselingen is gelijk aan respectievelijk 1000 J en 900 J met warme en koude bronnen.
Volgens de eerste wet van de thermodynamica is de variatie van de interne energie in deze thermische cyclus, in joules,
a) 0
b) 100
c) 800
d) 900
e) 1000
Resolutie
Alternatief a.
Laten we de oefening oplossen met behulp van de eerste wet van de thermodynamica, let op:

Volgens de verklaring wordt ons gevraagd om de variatie van interne energie in een gesloten thermodynamische cyclus te berekenen, in welk geval we weten dat de de interne energievariatie moet nul zijn, aangezien de machine weer zal werken op dezelfde temperatuur als aan het begin van de cyclus.
Vraag 2)(Upf) Een monster van een ideaal gas zet uit door het volume ervan te verdubbelen tijdens een isobare en adiabatische transformatie. Aangezien de druk die door het gas wordt ervaren 5,10 is6 Pa en zijn aanvankelijke volume 2.10-5 m³, kunnen we zeggen:
a) De warmte die tijdens het proces door het gas wordt geabsorbeerd, is 25 cal.
b) De arbeid die het gas verricht tijdens zijn expansie is 100 cal.
c) De interne energievariatie van het gas is –100 J.
d) De gastemperatuur blijft constant.
e) Geen van bovenstaande.
Resolutie
alternatief c.
Met behulp van de informatie uit de oefeningsverklaring, zullen we de Eerste Wet van de Thermodynamica gebruiken om het juiste alternatief te vinden:
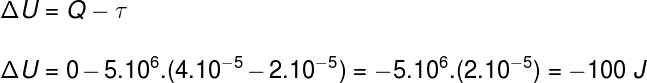
Vraag 3)(Wauw) Een keukenbus bevat gas onder hoge druk. Als we deze cilinder openen, merken we dat het gas snel in de atmosfeer ontsnapt. Omdat dit proces erg snel gaat, kunnen we het als een adiabatisch proces beschouwen.
Aangezien de eerste wet van de thermodynamica wordt gegeven door ΔU = Q - W, waarbij ΔU de verandering in energie is in het gas, Q is de energie die wordt overgedragen in de vorm van warmte en W is het werk dat door het gas wordt gedaan, dit is correct verklaar dat:
a) Gasdruk nam toe en temperatuur daalde.
b) Het werk van het gas was positief en de gastemperatuur veranderde niet.
c) De arbeid van het gas was positief en de gastemperatuur daalde.
d) De gasdruk nam toe en het uitgevoerde werk was negatief.
Resolutie
alternatief c.
Zodra het gasvolume uitzet, zeggen we dat het uitgevoerde werk positief was, dat wil zeggen dat het gas zelf werk aan de externe omgeving heeft uitgevoerd. Bovendien, omdat het proces zeer snel verloopt, is er geen tijd voor het gas om warmte uit te wisselen met de omgeving, dus gebeurt het volgende:
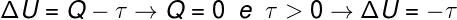
Volgens de berekening neemt de interne energie van het gas af met een hoeveelheid die gelijk is aan de verrichte arbeid. door het gas, bovendien, aangezien er een afname is in de interne energie van het gas, is er ook een afname in temperatuur.
Vraag 4)(Udesc) In een natuurkundig laboratorium wordt geëxperimenteerd met een gas dat voor thermodynamische analyse als een ideaal gas kan worden beschouwd. Uit de analyse van een van de experimenten, waarbij het gas aan een thermodynamisch proces werd onderworpen, werd geconcludeerd dat alle aan het gas toegevoerde warmte werd omgezet in arbeid.
Vink het alternatief aan dat staat voor correct het thermodynamische proces uitgevoerd in het experiment.
a) isovolumetrisch proces
b) isotherm proces
c) isobaar proces
d) adiabatisch proces
e) samengesteld proces: isobaar en isovolumetrisch
Resolutie
alternatief b.
Om alle aan een gas toegevoerde warmte te laten omzetten in arbeid, mag er geen interne energie worden geabsorbeerd door: het, met andere woorden, het gas moet door een isotherm proces gaan, dat wil zeggen een proces dat plaatsvindt bij temperatuur constante.
Door Rafael Hellerbrock
Natuurkunde leraar
Bron: Brazilië School - https://brasilescola.uol.com.br/fisica/primeira-lei-da-termodinamica.htm
