Tot 1824 werd aangenomen dat de gebouwde thermische machines een werking konden ondergaan perfect, dat wil zeggen, men dacht dat ze een opbrengst van 100% zouden kunnen bereiken, of iets dat daar in de buurt komt waarde. Met andere woorden, wetenschappers geloofden destijds dat ze alle thermische energie konden gebruiken geleverd aan deze machines - dat wil zeggen, ze geloofden dat ze al die energie konden omzetten in werk.
Ingenieur Sadi Carnot was destijds verantwoordelijk voor het maken van demonstraties waarbij het onmogelijk was om 100% rendement te behalen. Sadi stelde voor dat een ideale theoretische thermische machine een bepaalde cyclus zou doorlopen, die nu wordt genoemd Carnot-cyclus.
In zijn demonstratie conceptualiseerde Carnot twee postulaten, die al werden voorgesteld voordat de eerste wet van de thermodynamica was uitgesproken. Zie wat de postulaten van Carnot verkondigen:
1e postulaat van Carnot
- Geen machine die tussen twee vaste temperaturen werkt, kan meer opleveren dan de ideale machine van Carnot die tussen diezelfde temperaturen werkt.
2e postulaat van Carnot
- Als de machine tussen twee temperaturen werkt, ideaal van Carnot heeft dezelfde efficiëntie, ongeacht de bedrijfsvloeistof, en is volledig omkeerbaar, zonder energie toe te voegen.
Volgens de postulaten van Carnot kunnen we de garantie zien dat het rendement van een thermische motor een functie is van de temperaturen van de warme en koude bronnen. Door de temperaturen van deze bronnen vast te stellen, is de theoretische machine van Carnot echter degene die de hoogste efficiëntie weet te behalen.
De Carnot-cyclus is een geïdealiseerde, omkeerbare cyclus, waarin de bedrijfsvloeistof een perfect gas is, wat overeenkomt met twee transformaties. isothermen het is twee adiabatisch, afgewisseld. De door het gas beschreven processen in deze cyclus zijn:
1.°) isotherme expansie DA, waarbij het gas in contact staat met het constante temperatuursysteem TA (warme bron) en daaruit een hoeveelheid warmte QA ontvangt.
2.°) adiabatische expansie AB, waarbij geen warmte-uitwisseling met de omgeving plaatsvindt. Het systeem voert werkzaamheden uit met een afname van de interne energie en dus van de temperatuur.
3.°) BC isotherme contractie, waarbij het gas in contact staat met het constante temperatuursysteem TB (koude bron), waardoor het een hoeveelheid warmte QB krijgt.
4.°) adiabatische contractie CD, waarbij het gas geen warmte uitwisselt met de omgeving. Het systeem ontvangt werk, dat dient om zijn interne energie en dus zijn temperatuur te verhogen.
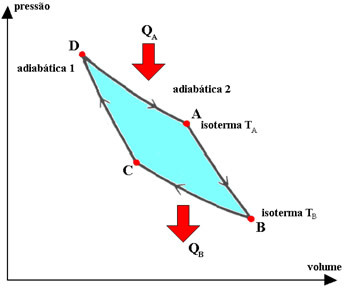
In de Carnot-cyclus wordt warmte uitgewisseld (VraagDE en QB) en thermodynamische temperaturen (TDE en TB) van de warme en koude bronnen zijn proportioneel, de relatie is:

Als we de efficiëntievergelijking van een thermische machine substitueren, krijgen we voor de Carnot-machine:
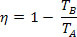
Gezien de temperatuur van de koude bron (TB) gelijk aan nul kelvin (absoluut nul), we hebben η = 1 of η = 100%. Dit feit is echter in tegenspraak met de tweede wet van de thermodynamica, die garandeert dat een inkomen van 100%, wat ons tot de conclusie brengt dat geen enkel fysiek systeem een temperatuur kan hebben gelijk aan nul absoluut.
Door Domitiano Marques
Afgestudeerd in natuurkunde
Bron: Brazilië School - https://brasilescola.uol.com.br/fisica/maquinas-carnot.htm

