U aldehyden en de ketonen het zijn zeer vergelijkbare organische functies. Beide hebben in hun structuur de functionele carbonylgroep (C = O), met het enige verschil dat, in het geval van aldehyden, verschijnt het altijd aan het einde van de koolstofketen, dat wil zeggen, een van de carbonylkoolstofliganden is de waterstof; ketonen hebben de carbonyl tussen twee andere koolstofatomen.
Aldehyden functionele groep:Functionele groep ketonen:
O O
║ ║
C C ─ H C C ─ C
Om deze reden zijn er gevallen van functionele isomerie tussen aldehyden en ketonen. Hieronder presenteren we bijvoorbeeld twee functionele isomeren met dezelfde molecuulformule (C3H6O), maar de ene is een aldehyde (propanal) en de andere is een keton (propanon). Zie hoe dit hun eigenschappen en toepassingen totaal verandert:
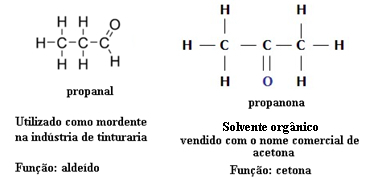
Voorbeeld functie isomerie tussen aldehyde en keton
Stel je voor dat je in een laboratorium bent en je vindt een flesje met een kleurloze vloeistof met alleen de molecuulformule C3H6O. Wat zou je doen om erachter te komen of het een keton of een aldehyde is?
Om dit soort problemen op te lossen, er zijn methoden om aldehyden en ketonen te differentiëren op basis van de reactie van deze verbindingen tegen zwakke oxidatiemiddelen. Zoals hieronder getoond, wanneer ze worden geconfronteerd met zwakke oxidanten, reageren aldehyden door te worden geoxideerd, terwijl ketonen niet reageren. Wij zeggen dataldehyden werken als reductiemiddelen, maar ketonen niet, ze reageren alleen als reductiemiddelen in contact met energetische oxidatiemiddelen.
Aldehyden + zwakke oxidatiemiddelen → carbonzuur
O O
║ ║
C ─ C ─ H + [O] → C ─ C ─ OH
Ketonen + zwakke oxidatiemiddelen → Niet reageren
O
║
C ─ C ─ C + [O] → Er vindt geen reactie plaats
Op basis daarvan is het dan voldoende om deze reactie uit te voeren en te kijken of de verbinding reageert of niet. Als het reageert, weten we dat het een aldehyde is; als het niet reageert, is het een keton.
Bovendien zijn de producten die bij deze aldehyde-oxidatiereacties worden gevormd, goed zichtbaar, waarbij kleurveranderingen optreden, zoals later zal worden aangetoond.
Er zijn drie hoofdmethoden om aldehyden en ketonen te onderscheiden, namelijk:
1- Tollens reactief: Dit reagens is een ammoniakoplossing van zilvernitraat, dwz het bevat zilvernitraat (AgNO3) en overtollig ammoniumhydroxide (NH4OH):
AgNO3 + 3 NH4OH → Ag (NH3)OH + NH4BIJ DE3 + 2 H2O
Tollens Reactive (vernoemd naar de Duitse chemicus Bernhard Tollens (1841-1918))
Zoals uitgelegd in de tekst Een zilveren spiegel maken, wanneer een aldehyde in contact wordt gebracht met reactief Tollens, wordt het geoxideerd tot het overeenkomstige carbonzuur, terwijl zilverionen worden gereduceerd tot Ag0 (Metallisch zilver). Als deze reactie wordt uitgevoerd, bijvoorbeeld in een reageerbuis, zal dit metallische zilver neerslaan op de wanden van de buis, wat resulteert in de vorming van een film genaamd a zilveren spiegel. Dit waargenomen resultaat is erg mooi en wordt gebruikt in het industriële productieproces van spiegels.
De reactie die plaatsvindt kan als volgt worden weergegeven:
O O
║ ║
R ─ C ─ H + H2O → R ─ C ─ OH + 2e- + 2 H+
2 Ag+ + 2e- → 2 Ag0
2 NH3 + 2 H+ → 2 NH4+
O O
║║
R C ─ H + 2 Ag+ + 2 NH3 +H2O → R C OH + 2 Ag0 + 2 NH4+
aldehyde Tollens reactiefcarbonzuur metallic zilver (zilveren spiegel)
Aan de andere kant, als we het keton laten reageren met het reactieve Tollens, zal de vorming van metallisch zilver niet plaatsvinden, omdat de ketonen de Ag-ionen niet kunnen verminderen.+.
2- Fehling reactief: Deze reactieve is een blauwe oplossing van kopersulfaat II (CuSO4) in een basisch medium, aangezien het wordt gemengd met een andere oplossing gevormd door natriumhydroxide (NaOH) en natrium- en kaliumtartraat (NaOOC-CHOH-CHOH-COOK). Tartraat wordt toegevoegd aan de koper II-sulfaatoplossing om het te stabiliseren en precipitatie te voorkomen.
CUSO4 + 2 NaOH → Na2ENKEL EN ALLEEN4 + Cu(OH)2
Fehling Reactive (vernoemd naar de Duitse chemicus Hermann von Fehling (1812-1885))
In contact met Fehling's reactieve, vormt een aldehyde het carbonzuur door zijn oxidatie, terwijl koperionen (Cu)2+) die in het midden aanwezig zijn, worden gereduceerd en vormen een roodbruin neerslag (meer baksteenachtig van kleur), dat koperoxide is. Ketonen daarentegen reageren niet - omdat ze Cu-ionen niet kunnen verminderen2+.
O O
║ ║
R ─ C ─ H + 2 Cu(OH)2 → R ─ C ─ OH + kont2O + 2 H2O
aldehyde roodbruin neerslag
3- Benedict's reactief: Dit reactieve wordt ook gevormd door een oplossing van koper II-sulfaat (Cu (OH)2) in een basisch medium, maar het is gemengd met natriumcitraat.
Net als bij het reagens van Fehling zijn er in het geval van de reactie tussen het aldehyde en het reagens van Benedictus ook koperionen (Cu2+) aanwezig in het medium die gereduceerd zijn en rood koperoxide vormen.
Dit reagens wordt veel gebruikt in tests om de aanwezigheid en het gehalte van glucose in de urine te detecteren. Glucose heeft een aldehydegroep in zijn structuur, dus het reageert met Benedict's reagens dat in strips aanwezig is voor deze tests. Vergelijk vanaf daar gewoon de kleur van het lint met de kleur van de schaal op de verpakking van het product.

Benedict's reagens wordt gebruikt om het glucosegehalte in urine te bepalen.
Door Jennifer Fogaça
Afgestudeerd in scheikunde
Bron: Brazilië School - https://brasilescola.uol.com.br/quimica/diferenciacao-aldeidos-cetonas.htm

