Zoutzuur is een hydracid met een hoog ionisatiepotentieel, het is een geelachtige vloeistof, zeer corrosief en giftig. Het wordt gebruikt in verschillende industriële processen, zoals de vervaardiging van reinigingsproducten en farmaceutische hydrochloriden, in voedingsmiddelen en in staalproductieprocessen.
Het is ook aanwezig in het menselijk organisme; O maagsap die werkt bij de vertering van eiwitten is een zure oplossing; van zoutzuur en andere stoffen, zoals enzymen en zouten. Blootstelling, inademing of inslikken van Geconcentreerd zoutzuur is zeer schadelijk voor de gezondheid, die zelfs de dood tot gevolg kunnen hebben.
Lees ook: Zwavelzuur - stof met een hoog corrosief vermogen
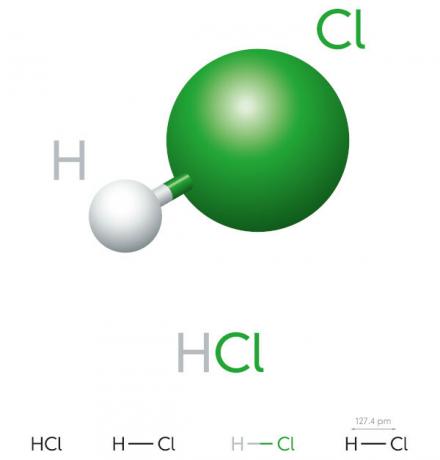
Zoutzuur eigenschappen:
- anorganische verbinding
- sterk zuur
- Hoog ionisatiepotentieel
- Vloeistof
- geelachtig uiterlijk
- Giftig
- Bijtend
- vluchtig
- Hygroscopisch (neigt te absorberen) áwater van het milieu)
- Oplosbaar in water
Niet stoppen nu... Er is meer na de reclame ;)
Zoutzuurproductie
Het zoutzuur was ontdekt door een moslimalchemist genaamd Jabir Ibne Haiane, ook bekend als Gaber en beschouwd als de vader van de Arabische chemie. Hij synthetiseerde de stof op basis van a reactie tussen zeezout (NaCl) en de zwavelzuur (Bij2ENKEL EN ALLEEN4).
2NaCl + H2ENKEL EN ALLEEN4 → In2ENKEL EN ALLEEN4 + 2HCl
Momenteel zoutzuur wordt op grote schaal geproduceerd door de elektronischólyse natriumchloride in waterige oplossing. Uit dit proces wordt gas verkregen chloor- (Cl2), gas waterstof (H2) en natriumhydroxide (NaOH). Chloor- en waterstofgassen reageren om zoutzuur te vormen:
kl2 + H2 → 2HCl
Echter, deze reactie is extreem exotherm en zeer gevaarlijk. Momenteel wordt het meeste van het industrieel geproduceerde zoutzuur geassocieerd met de productie van organische verbindingen, wat een zuiniger en veiliger proces is.
RH + Cl2 → R-Cl + HCl
(Beschouw R als een organisch radicaal.)
Zie ook: Tips om te bepalen-als de sterkte van zuren

Zoutzuur toepassing:
- Metalen beitsen: Zoutzuur wordt gebruikt om metalen te "reinigen" voordat ze worden verwerkt, waardoor roest, kalkaanslag en andere onzuiverheden van hun oppervlak worden verwijderd.
- Productie van organische verbindingen: zoutzuur wordt gebruikt als reagens om vinylchloride te verkrijgen, dat wordt gebruikt bij de vervaardiging van kunststoffen. Zoutzuur komt ook uit chloropreen, dat wordt gebruikt in synthetische rubbers.
- Productie van anorganische verbindingen: zoutzuur is aanwezig in verschillende industriële processen voor de productie van reagentia en verbindingen Anorganische producten, waaronder producten voor waterbehandeling, zoals ijzer(III)chloride en ijzer(III)chloride aluminium.
- Gebruikt als schoonmaakmiddel: Zoutzuur, dat ook op de markt wordt gebracht als zoutzuur, wordt gebruikt voor de post-constructie, huishoudelijke en chemische reiniging van gereedschappen en machines.
- Voedselverwerking: Zoutzuur wordt toegepast in verschillende reacties voor de productie van voedsel en additieven, zoals hydrolyse van zetmeel en eiwitten, of in het eindproduct voor pH-balans.
- Geneesmiddelenproductie: Zoutzuur wordt gebruikt bij de productie van oplosbare hydrochloriden die aanwezig zijn in verschillende geneesmiddelen, zoals doxycyclinehydrochloride, gebruikt bij de behandeling van buiktyfus en pokken.
Zoutzuur in het lichaam
Zoutzuur is aanwezig in onze spijsverteringsstelsel, het maagsap dat door onze maag wordt geproduceerd, is een oplossing van water, enzymen, zoutzuur, anorganische zouten en een klein percentage melkzuur.
O voedselcake wordt omgezet in chymus, een zure massa (dankzij de werking van het maagsap en de zure samenstelling), dit is wanneer de vertering van eiwitten, getransformeerd in polypeptiden en aminozuren dat wordt opgenomen door het lichaam.
Gevaren van zoutzuur
Zoutzuur is een zeer sterk en bijtend zuur, dus contact met de stof veroorzaakt verschillende schades:
- Huid: Veroorzaakt brandwonden en irritatie.
- Ogen: Veroorzaakt ernstige irritatie en kan blindheid veroorzaken.
- Inademing: Veroorzaakt irritatie en letsel aan de bovenste luchtwegen.
- inslikken: veroorzaakt corrosie in het hele orale systeem en in het maagdarmkanaal, kan braken, bloedingen, diarree, problemen met de bloedsomloop veroorzaken, wat kan leiden tot de dood.
- Blootstellingwordt vervolgd: valt eerst de slijmvliezen aan, waardoor dermatitis en conjunctivitis, bloedend tandvlees, fotosensibilisatie; frequente inademing, zelfs in een lage concentratie van de verbinding, kan leiden tot: gastritis en neusbloedingen.
Ook toegang: Kenmerken en eigenschappen van azijnzuur

opgeloste oefeningen
Vraag 1 - (Udesc) Met betrekking tot zoutzuur kan worden gezegd dat:
A) in een waterige oplossing laat het elektrische stroom door.
B) is een dizuur.
C) is een zwak zuur.
D) heeft een lage ionisatiegraad.
E) is een ionische stof.
Resolutie
Alternatief A. Zoutzuur is geen dizuur, omdat het maar één ioniseerbare H heeft, maar één sterk zuur, moleculaire stof met een hoog ionisatiepotentieel. DE ionisatie in een waterig medium bevordert de geleiding van elektrische stroom door het bestaan van vrije ionen.
Vraag 2 - In een oplossing van zoutzuur en water kunnen we stellen dat het voorkomen van moleculair waterstofchloride (HCl) minimaal is, dit komt omdat
A) zoutzuur in contact met water wordt verdund.
B) waterstofchloride is een stof die niet oplost in water.
C) waterstofchloride heeft een hoog ionisatiepotentieel, daarom vormt het HCl-molecuul in een waterig medium H-ionen+ kl-.
D) het zoutzuur, dat zeer vluchtig is, scheidt zich af van de oplossing en laat alleen watermoleculen achter.
E) zoutzuur is een ionische stof, daarom dissocieert het in een waterige oplossing en vormt het ionen.
Resolutie
alternatief C.
A) Het antwoord komt niet overeen met de vraag, het verdunnen van zoutzuur in water rechtvaardigt niet de afwezigheid van moleculair HCl.
B) Onjuist, waterstofchloride is oplosbaar en heeft affiniteit met water.
C) Correct
D) Hoewel zoutzuur vluchtig is, komt deze scheiding van de twee soorten in de oplossing niet significant voor.
E) Zoutzuur is een oplossing van waterstofchloride en water, waarbij waterstofchloride een niet-ionische moleculaire stof is.
Door Laysa Bernardes Marques de Araujo
Scheikundeleraar
Wil je naar deze tekst verwijzen in een school- of academisch werk? Kijken:
ARAúJO, Laysa Bernardes Marques de. "Zoutzuur"; Brazilië School. Beschikbaar in: https://brasilescola.uol.com.br/quimica/Acido-cloridrico.htm. Betreden op 27 juni 2021.



